Prof. Dr Midhat Jašić
Tehnološki fakultet, Tuzla
Tel.: +387 61 721060; +387 35 320745
E-mail: jasic_midhat@yahoo.com
E-mail: midhat.jasic@untz.ba
.
.
Peptidi
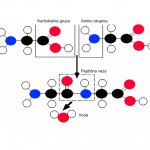
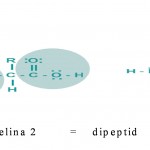
Najvažnija hemijska reakcija aminokiselina je formiranje peptidne veze između karboksilne grupe jedne aminokiseline (-COOH) i amino grupe (-NH2) druge aminokiseline, u kojoj se atom ugljenika vezuje za atom azota uz oslobađanje molekula vode. Aminokiseline se međusobno vežu tako da reakcijom između karboksilne skupine jedne i amino skupine druge aminokiseline nastane amid. Tako nastali amidi zovu se peptidi, a veza između njih je amidna (peptidna) veza. Oko veze između karbonilnog ugljika i azotova atoma nema slobodne rotacije jer ta veza djelomice ima svojstva dvostruke veze.
Međusobnim povezivanjem manje od 100 aminokiselina nastaju peptidi. Ako se dvije aminokisline povežu nastaje dipeptid, ako se povežu tri onda je tripeptid.
Ovisno o tome koja od aminokiselina reagira s amino skupinom, ili karboksilnom skupinom, dvije se aminokiseline mogu međusobno vezati na dva načina. Stoga iz dvije aminokiseline mogu nastati dva različita dipeptida, u kojima aminokiselina na početku lanca ima slobodnu amino skupinu, a ona na kraju lanca karboksilnu skupinu. Dva kraja lanca amino kiseline se nazivaju karboksilni kraj (C-tеrminus) i amino kraj (N- tеrminus) na osnovu prirode njihove slobodne grupe na svakom kraju.
Tokom probave hrane enzimskom hidrolizom proteina i peptida troši se jedna molekula vode koja se “ugrađuje“ u molekule aminokiselina. Ponovnom sintezom proteina u organizmu oslobađa se molekula vode i nastaje takozvana endogena voda.
Kod nekih proteina oksidacijom cisteinskih ostataka nastaje disulfidna veza. Uz peptidnu vezu to je još jedina unakrsna kovalentna veza koja dolazi u proteinima.
Tabela 3.2.9. Neki biološki peptidi značajni u prehani
| Peptid | Funkcija |
| Glutation tripeptid (Glu-Cys-Gly). | Regulacija oksidoreduktivnih reakcija |
| Inzulin | Regulira metabolizem glukoze |
| Grelin | Stimulator apetita |
| Neuropeptid Y | Stimulator apetita |
| Aspartam, sintetični peptid | L-Asp-L-Phe. umjetno sladilo |
| Leptin | Supresor apetita |
| Holecistokinin (CCK) | Supresor apetita |
| Amilin | Supresor apetita |
| Ciklopeptidi | Otrovne tvari u gljivama |
.
Ključni pojmovi
- Najvažnija hemijska reakcija aminokiselina je formiranje peptidne veze.
- Peptidi su prirodni polimeri aminokiselina i nisu suštinski različiti od proteina.
- Osnovna razlika je da su peptidi polimeri male ukupne mase, dok proteini sadrže više od 100 aminokiselina i njihova molekularna masa je veća.
.
Proteini
Proteini su ključni gradivni elementi žive stanice svakog organizma. Nalaze se svugdje, u svim dijelovima ljudskog tijela, kao na primjer mozgu, krvi, noktima, kosi, a od proteina su građeni enzimi i neki hormoni. Tjelesni proteini se sintetiziraju pod uvjetom da u „pulu“ tokom metabolizma postoje sve esencijalne aminokiseline. Čim nedostaje jedna, manjak se nastoji kompenzirati sintezom. Ako to nije moguće, dolazi do poremećaja izraženog kao malnutricija. Proteini čine preko 20% mase čovjeka, s tim da u strukturi mišića, unutrašnjih organa, kože, kose, noktiju predstavljaju primarnu komponentu.
Proteini su važna komponenta u industrijskoj proizvodnji hrane jer imaju višestruku funkciju. Prirodni su sastojci hrane biljnog i životinjskog porijekla. U prerađenom obliku koriste se kao sredstva za vezanje vode, emulgiranje, popravljanje viskoziteta, obogaćivanje namirnica itd.
Prema definicniji EU protein je ukupni azot dobiven metodom po Kjeldahlu pomnožen s faktorom 6,25. Za razliku od ostalih supstanci iz hrane, proteini sadrže prosječno 16% azota, pa se njihovo laboratorijsko utvrđivanje temelji na utvrđivanju procenta azota.
Tabela 3.2.10. Elementarni sastav proteina
| Element | Maseni udio (%) |
| Ugljik | 50-55 |
| Vodik | 6,5-7,3 |
| Kisik | 19-24 |
| Azot | 15-18 |
| Sumpor | 0-2,4 |
Proteini, kao biološki polimeri, nastaju povezivanjem većeg broja aminokiselina, najčešće više od stotinu. Povezivanje se ostvaruje peptidnom vezom koja nastaje povezivanjem α-karboksilne skupine jedne aminokiseline i α-amino skupine druge aminokiseline. Tako nastaje nerazgranati polipeptidni lanac izgrađen od pravilno ponavljane okosnice ili glavnog lanca i međusobno različitih ogranaka. Svaki protein ima jedinstvenu aminokiselinsku sekvencu koja je određena sekvencom nukleotida u genu.
.
Osnovni pojmovi biološke sinteze proteina
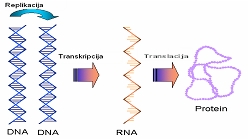
Tokom procesa biološke sinteze proteina u živom organizmu, tačan redoslijed aminokiselina u peptidnom lancu se uspostavlja za vrijeme procesa translacije. Prema središnjoj dogmi molekularne biologije slijed nukleotida u DNA , složenim staničnim procesima, se prevodi u slijed aminokiselina u proteinu. Informacija u DNA određuje strukturu proteina. Genetička informacija organizma sadržana je unutar genoma kojeg sačinjava ukupna DNA. Gen je funkcionalna jedinica genoma ili odsječak DNA koji kodira polipeptidni lanac ili molekulu RNA . Gen čini slijed nukleotida koji nosi informaciju za funkcionalni protein ili RNA molekulu. RNA je sastavljena od niza nukleotida i zadužena je za prevođenje nasljedne poruke zapisane u DNA u proteine. Postoje tri tipa RNA: glasnička RNA (mRNA) sadrži prijepis nasljedne upute, transportna RNA (tRNA) koja donosi aminokiseline tokom sinteze proteina i ribozomska RNA (rRNA) koja sudjeluje u građi ribozoma. Geni se sastoje od egzona i introna. Egzoni su slijedovi nukleotida unutar gena koji se prevode u protein. Introni su slijedovi nukleotida unutar gena koji se ne prevode u protein. Ekspresija gena je nastanak genskog produkta. Središnja dogma molekularne biologije objašnjava prijenos genske poruke u sistemu: DNA-RNA- protein.
DNA sadrži uputu za biosintezu proteina, preko redoslijeda baza. Replikacija (umnažanje) DNA je proces kojim se stvara identična kopija dvolančane DNA-molekule, koristeći postojeću uzvojnicu DNA kao kalup na kojem se stvara nova uzvojnica. Transkripcija je sinteza molekule RNA na molekuli DNA (ili prepisivanje genetičke upute – prepisivanje DNA u RNA). Translacija je sinteza proteina na ribosomima prema prijepisu genetičke upute odnosno prevođenje redoslijeda ribonukleotida u redoslijed aminokiselina. Translacija ili sinteza proteina, sastoji se iz tri faze: 1. inicijacije – započinjanja sinteze 2. elongacije – produživanja lanca i 3. terminacije – završetka sinteze. Polipeptidni lanac raste od amino kraja prema karboksilnom kraju.
.
Struktura proteina
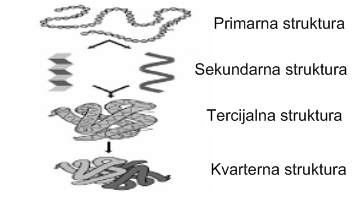
Za razumjevanje konstitucije proteina na molekularnom nivou potrebno je poznavanje njihove trodimenzionalne strukture. Za utvrđivanje strukture proteina koriste se tehnike kao što su kristalografija X zracima ili NMR spektroskopija. Eksperimentima sa ribonukleozom, enzimom koji hidrolizira RNA, a koje je proveo Christian Anfinsen , otkriveno je da slijed aminokiselina (primarna struktura) u nekom proteinu određuje njegovu trodimenzionalnu građu (konformaciju).
Proteini imaju 4 strukturna nivoa koji određuju izgled proteina u prostoru-konformaciju. Te strukture definiraju se kao: primarna, sekundarna, tercijarna i kvartarna struktura. Primarna struktura predstavlja slijed aminokiselina u polipeptidnom lancu. Ovaj slijed aminokiselina se održava kompaktnim pomoću kovalentne peptidne veze.
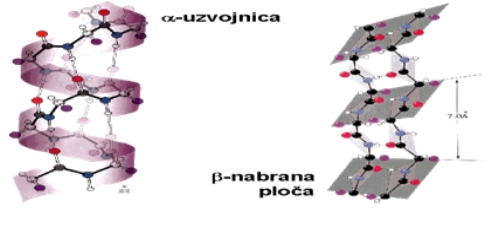
Sekundarne strukture predstavljaju izgled polipeptidnog lanca u prostoru. Sekundarne strukture se stabiliziraju hidrogenskim vezama . Sekundarna struktura je lokalna prostorna organizacija atoma okosnice polipeptidnog lanca neovisna o konformaciji pobočnih lanaca. Opisuje odnos i prostorni raspored susjednih aminokiselina u lancu. Razlikujemo dva tipa sekundarne strukture:
α,-uzvojnice i β,-nabrane ravni.
Tercijarna struktura je prostorni odnos aminokiselinskih ostataka međusobno vrlo udaljenih u linearnom slijedu. Tercijarna struktura se održava prvenstveno hidrofobnom interakcijom ali i hidrogenskim vezama, ionskom interakcijom i disulfidnom vezom koje su obično uključene u lanac. Zavisno od tercijarne strukture, proteini se dijele na fibrilarne i globularne. Fibrilarni proteini imaju vlaknastu strukturu i teško se otapaju u vodi. Globularni proteini imaju zbijenu strukturu loptastog oblika. Otapaju se u vodi pa zbog veličine molekula, formiraju koloide.
Kvartenarnu strukturu posjeduju proteini koji su sastavljeni iz više polipeptidnih lanaca. Ovaj nivo proteinske organizacije predstavlja prostorni raspored, odnosno međusobni odnos svih polipeptida koji tvore jedan protein. Znači da proteinski oligomeri odn. multimeri imaju kvartenarnu strukturu koja nastaje udruživanjem više proteinskih podjedinica-protomera. Ove podjedinice su međusobno povezane nekovalentnim vezama između pobočnih lanaca njihovih aminokiselinskih ostataka. U nekim slučajevima podjedinice su povezane i disulfidnim vezama. Neki oligomerni proteini su građeni od istih a neki od različitih podjedinica.
Protein se može mijenjati kroz nekoliko sličnih struktura u obavljanju svojih bioloških funkcija. U kontekstu ovih funkcionalnih preuređenja, tercijarne i kvartenarne strukture se obično nazivaju “konformacije“, a prelazi između njih konformacione promjene.
.
Podjela proteina
U odnosu na porijeklo, proteine dijelimo na biljne i životinjske. Životinjski proteini su bogatiji esencijalnim aminokiselinama, nego biljni. Vezivna životinjska proteinska tkiva imaju manje esencijalnih aminokiselina u odnosu na druga jestiva tkiva.
Prema sastavu i stepenu složenosti proteini se dijele na proste i složene. Struktura proteina može obuhvatiti i neproteinske molekule. U tom smislu razlikujemo homoproteine sastavljene od aminokiselina i heteroproteine, sastavljeni od proteinskog dijela i prostetske grupe:
Heteroprotein = apoprotein (protein) + prostetska grupa
Jednostavni ili prosti proteini građeni su samo od aminokiselina. Hidrolizom se razlažu samo do aminokiselina. Složeni proteini (heteroproteini) pored aminokiselina hidrolizom daju i druge materije kao što su ugljikohidrati, nukleinske kiseline, fosfor i sl.
Prosti proteini biljnog porijekla su prolamini i glutelini, a životinjskog albumini, globulini, protamini, histoni, skleroproteini.
Fibrilarni proteini imaju vlaknastu strukturu kao što je primjer fibroina svile. To podrazumijeva da su končasti pa se zovu još i vlakna. Relativno su velike dužine, imaju kvaternu prostornu strukturu.
Fibrilarni proteini se teško otapaju u vodi. Služe kao gradivne komponente organizma. Tu spadaju: kolagen, elastin, keratin, fibrinogen, miozin itd. Najpoznatiji fibrilarni proteini su kolagen i elastin, koji su osnovni konstituenti ekstracelularnog matriksa dajući čvrstinu vezivnim tkivima.
Kolagen je jedan od osnovnih strukturnih proteina u organizmu. To je jednostavni protein građen od nekoliko aminokiselina, ali iznimne čvrstoće i fleksibilnosti. Ulazi u sastav mišića, zglobova, tetiva i ligamenata. Kolagen je jak i dugačak molekul koji čini čak 25% svih proteina organizma sisara. Kolagena vlakna su glavna strukturna komponenta ekstracelularnog matriksa, za koju se vezuju druge strukture (elastin, proteoglikani, adhezivni proteini ekstracelularnog matriksa). Jako je važan u hrskavici, ligamentima, tetivama, kostima, zubima. Omogućava zategnutost kože i krvnih sudova. Prisutan je i kao kristalin u očnom sočivu. Jedan od ključnih procesa u sintezi kolagena je hidroksilacija, koja određuje čvrstoću kolagenske uzvojnice. U hidroksilaciji aminokiseline prolina u hidroksiprolin sudjeluje vitamin C, koji određuje kvalitetu nastalih kolagenih vlakana. Deficit faktora bitnih za hidroksilaciju, poput bakra ili vitamina C dovodi do loše kvalitete kolagena, što za posljedicu dovodi do skorbuta.
Mnoga tkiva i organi u organizmu moraju biti jaka i elastična. To omogućavaju elastinska vlakna. Elastin daje elastičnost tkivima i uvijek se nalazi uz nerastegljiviji kolagen kako bi se ograničilo rastezanje datih tkiva.
Keratin se nalazi u kosi, noktima, dlakama, perju, rogovima, papcima i sadrži veće količine aminokiseline cistein. Keratin je najjači protein koja je odgovoran za stabilnost i oblik stanice. Određene podgrupe ovog proteina su glavni sastojak kose i dlake sisavaca, ljusaka kod gmazova, perja, noktiju, kandži, rogova itd. Fibrinogen je plazmin glikoprotein i sudjeluje u zgrušavanju krvi. Po hemijskom sastavu spada u globuline. Miozin se nalazi u mišićima, sudjeluje u kontrakciji mišića.
Globularni proteini imaju sferičnu, loptastu strukturu, pa se zovu i sferoproteini. Tu spadaju: histoni, albumini i globulini. Histoni su okruglasti proteini stanične jezgre vezani uz nukleinske kiseline oko kojih se mota DNK. Histoni su relativno mali bazični proteini sa visokom učestalošću pozitivno nabijenih aminokiselina lizin i arginin, što im omogućava čvršće vezanje za negativno nabijenu DNA. Albumin je tip jednostavnog hidrosolubilnog proteina široko rasprostranjenog u mnogim tkivima i tekućinama u biljnom i životinjskom svijetu. Inačice albumina nalaze se u krvi, mlijeku, bjelanjku jajeta (albumen – bjelance), mesu, ječmu i mišiću. Biološki je punovrijedan protein, koji je topiv u vodi. U mlijeku se nalazi u sirutki, znači vodenom dijelu, za razliku od kazeina koji se odvaja u masni dio. U ljudskom organizmu obavlja funkciju transporta, održavanje acidobazne ravnoteže i osmotskog tlaka.
Globulini se nalaze u plazmi, a izmedju ostalog imaju funkciju zaštita organa. Ima ih u mlijeku, mesu, jajima itd. Otapaju se u vodi i zbog veličine molekula, formiraju koloide. Globularnim proteinima pripada: hemoglobin, mioglobin, enzim ribonukleaza, enzim lizozim, citokrom C, imunoglobulin, aktin te membranski proteini, na primjer, enzim-laktoza permeaza ili rodopsin, receptor važan u transdukciji svjetlosnih signala.
Složeni proteini. Složeni proteini zovu se i proteidi. Građeni su od prostetske skupine i proteinskog dijela. Prostatska skupina nije protein. To podrazumijeva da složeni proteini u svom sastavu imaju, osim amino-kiselina i nebjelančevinastu komponentu. Ta nebjelančevinasta komponenta može biti lipid, šećer, nukleinska kiselina ili specifična bojena materija. Prema prirodi te komponente, proteine možemo podijeliti na gradivne i biološki aktivne. Gradivni proteini, zajedno sa drugim organskim makromolekulima, ulaze u građu protoplazme. Biološki aktivni proteini učestvuju u regulaciji metaboličkih procesa i ostalih funkcija živih bića.
Tabela br 3.2.11. Složeni proteini
| Naziv proteina | Konstituenti proteina |
| Metaloproteini | prostetska skupina metal (transferin) + protein |
| Lipoproteini | lipid + protein, HDL, LDL, VLDL |
| Glikoproteini | šećer + protein |
| Nukleoprotein | nukleinska kiseline + protein |
| Fosfoproteini | fosfor + protein |
| Kromoproteini | Obojena prostetska grupa + protein (hemoglobin) |
.
Denaturacija i renaturacija proteina.
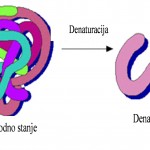
Termičkom obradom proteina, tretiranjem bazama i kiselinama, sušenjem, soljenjenjem, zračenjem dolazi do njihove denaturacije. Pod uticajem različitih faktora (kiseline, baze, promjena pH, visoke temperature i sl.), trodimenzionalna struktura proteina se može narušiti pri čemu dolazi do odmotavanja lanaca. Ta promjena se naziva denaturacijom proteina.
Denaturacija proteina može biti:
- reverzibilna (povratna), a uzrokuju je razrjeđeni alkoholi i soli lakih metala
- ireverzibilna – uzrokuju je UV i X zračenja, organska otapala, jake kiseline i baze, visoka temperatura i soli teških metala

Pri porastu koncentracije denaturansa dolazi do vrlo oštrog prelaza nativnog uvijenog oblika u odvijeni, denaturirani oblik proteina
Denaturacija proteina značajna je u svim biološkim sistemima, bilo da se radi o probavi hrane ili o njenoj preradi u industriji. Termički tretman hrane uzrokuje složene hemijske procese koji uključuju i denaturaciju proteina, te najčešće poboljšanje njihove probavljivosti i biološke iskoristivosti u ljudskom organizmu. Denaturacijom enzima prisutnih u hrani pri povišenim temperaturama vršimo njihovu inaktivaciju i taj proces je poznat kao blanširanje.
.
Ključni pojmovi
- Proteini su polimeri aminokiselina.
- Proteini nastaju tokom procesa replikacije, transkripcije i translacije.
- Regulacija njihovog nastanka determinirana je genetskim kodom.
- Na molekularnom nivou imati primarne, sekundarne, tercijerna i kvarterne strukture.
- Dijele se prema porijeklu na biljne i animalne.
- Prema hemijskoj strukturi mogu se podijeliti na proste i složene.
- Prosti proteini građeni samo od aminokiselina, a složeni pored aminokiselina u svom sastavu mogu imati ugljikohidrate, nukleinske kiseline, fosfor i sl.
- Prosti proteini biljnog porijekla su prolamini i glutelini, a životinjskog albumini, globulini, protamini, histoni, skleroproteini.
- Složeni proteini su metaloproteini, lipoproteini, glikoproteini, nukleoproteini, fosfoproteini, kromoproteini i drugi.
- Prema obliku molekula proteini se dijele na fibrilarne i globularne.
- Fibrilarni proteini su: kolagen, elastin, keratin, fibrinogen, miozin itd.
- Globularni proteinisu: histoni, albumini i globulini.
- Proteini pod utjecajem vanjskih faktora, temperature, kiselina, baza, soli denaturiraju
.
Literatura
Spisak korišćene literature možete naći u Literatura – Hemija hrane.