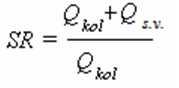Autor: dipl. ing. Dušica Ivanov
Mentor: prof. dr Nikola Marjanović
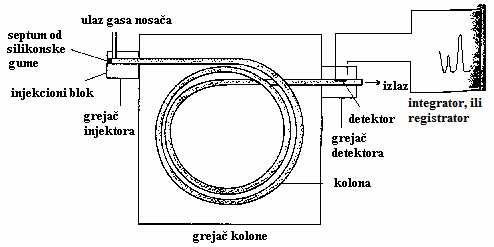
Slika 8. Šematski prikaz gasnog hromatografa
Razdvajanje komponenata iz smeše gasnom hromatografijom zasniva se na razlici u koeficijentima raspodele između stacionarne tečne i mobilne gasovite faze (gas nosač). Šema gasnog hromatografa prikazana je na slici 9. Tehnika se primenjuje samo za ona jedinjenja koja se nalaze u gasovitom stanju, ili se pogodnim metodama mogu prevesti u gasovito stanje. Masti i ulja imaju relativno veliku molekulsku masu i nizak napon pare, pa se teško mogu direktno ispitivati gasnom hromatografijom. Prevođenjem masnih kiselina u metil-estre, koji imaju znatno nižu tačku isparavanja i stabilniji su, prevazilaze se navedeni problemi [40].
.
Gas nosač
Osobine gasa nosača utiču na efikasnost razdavajanja, vreme analize i osetljivost detektora, pa se njegovom odabiru posvećuje velika pažnja. Bitno je da sve karakteristike gasa nosača ostanu konstantne (što je moguće više) tokom kretanja kroz aparaturu. Gas struji kroz kolonu i sa sobom nosi uzorak u gasovitom stanju. Pri proticanju se, zbog različitih koeficijenata raspodele, komponente iz smeše razdvajaju i kao takve dospevaju u detektor [23].
Kao gasovi nosači koriste se: helijum, azot, argon i vodonik, ređe ugljen-dioksid, kiseonik i vazduh [41]. Gasovi moraju biti permanentni, hemijski inertni prema analitima, malog viskoziteta, niske cene i odlikovati se velikom čistoćom (99,99%) i dobrom termičkom provodljivošću (ukoliko se koristi detektor termičke provodljivosti). Obično se čuvaju u bocama od 40 dm3 , pod pritiskom od 15 MPa (150 bar), osim CO2, koji se čuva pod pritiskom od 6 MPa.
Pritisak od 150 bar-a na izlazu iz boce se redukuje membranskim redukcionim ventilom na oko 4-5 bar-a, a potom se pre ulaza u kolonu fino podešava igličastim ventilom. Protok gasa meri se uređajima sa sapunskim mehurovima, rotametrima,a kod automatizovanih gasnih hromatografa koristi se instrument, čiji je osetni element anemometar sa zagrejanim vlaknom.
Optimizacija protoka mobilne faze izvodi se pomoću Van Deemterove jednačine. Apscisa minimuma krive zavisnosti visine ekvivalenta teorijskog poda od brzine kretanja gasa predstavlja optimalnu brzinu strujanja gasa nosača [40]. Najveća efikasnost postiže se upotrebom vodonika, ili azota, ali je problem mala širina minimuma krive za N2, pa sa malim odstupanjima od optimalne brzine, efikasnost naglo opada. U kombinaciji GC-MS, N2 daje jon m/z = 28, pa je onemogućeno snimanje masenih spektara ispod ove vrednosti. Osim toga, MS radi pod većim vakuumom, zbog čega i sistem pumpi mora biti snažniji, zbog čega se helijum pokazao kao mnogo pogodniji. Uobičajeni protok mobilne faze u ovakvom sistemu sa kvadrupolnim analizatorom iznosi 1 do 2 ml/min. Gas nosač propušta se kroz molekulsko sito, koje se nalazi iza redukcionog ventila boce sa gasom, a pre ulaza u kolonu, da bi se uklonila vlaga i druge nečistoće [23].
U ovom diplomskom radu za prečišćavanje mobilne faze korištena je kolona Oxisorb®.
.
Kolone
Prema nameni, kolone za gasnu hromatografiju se dele na preparativne i analitičke, ali je mnogo rasprostranjenija podela prema načinu pripreme i prečniku, na kolone sa punjenjem i kapilarne.
Standardne punjene kolone su dužine od 1,5 do 10 m, prečnika od 2 do 4 mm, sadržaj likvidne faze iznosi od 5 do 10%, a prosečni prečnik zrna inertnog nosača od 100 do 150 μm. Inertni nosači obično su izrađeni od materijala na bazi dijatomejske zemlje [40].
Kapilarne kolone dele se na:
1) Fused sillica WCOT – izrađene su od amorfnog silikatnog materijala, oslobođenog metalnih oksida, zbog čega pokazuje veliku inertnost. Vrlo su fleksibilne, a radi pojačanja se sa spoljašnje strane presvlače polimernim materijalima. Likvidna faza se u unutrašnjosti kolone ne vezuje fizičkim silama, već kovalentnim vezama preko silanolnih (Si-OH) grupa. Pokazuju veliku stabilnost pri povišenim temperaturama i čistoću, a čak i minorne organske primese poreklom od stacionarne faze mogu se ukloniti propustanjem odgovarajućeg rastvarača [42]. Osnovni nedostatak ovih kolona je visoka cena i nedovoljno razvijeni postupci vezivanja polarnih likvidnih faza [7].
2) WCOT ( Wall-Coated Open Tubular) – standardne kapilarne kolone, danas gotovo potpuno van upotrebe. Unutrašnji zid im je prevučen samo stacionarnom likvidnom fazom. Izrađuju se u dužini do 200 m, prečnika 0,25 – 0,5 mm. Proizvode se od stakla koje se prethodno hemijski tretira, ne bi li se osiguralo dobro prekrivanje površine i ujednačena debljina likvidnog sloja. Ove kolone pokazuju manju lomljivost, nego što se predpostavlja, a problemi se uglavnom javljaju prilikom postavljanja, ili pomeranja kapilara iz grejača gasnog hromatografa [42].
3) SCOT ( Support Coated Open Tubular) – kapilarne kolone sa unutrašnjim zidom prevučenim stacionarnom likvidnom fazom i sprašenim inertnim nosačem, prečnika oko 1mm, dužine 15-100 m, prečnika zrna inertnog nosača oko 1 μm [40].
4) PLOT (Porous Layer Open Tubular) – kapilarne kolone sa unutrašnjim zidom stopljene silike prevučenim slojem adsorbensa [42].
5) mikropakovane kolone- izrađuju se od nerđajućeg čelika (ne preporučuju se pri analizi masnih kiselina) i stakla, koje je mnogo povoljniji materijal, jer je inertnije, lako se vidi da li je kolona dobro pakovana i da li se pojavljuju praznine u punjenju tokom upotrebe. U potpunosti su ispunjene inertnim nosačem sa stacionarnom likvidnom fazom na njemu. Nosač se dodaje koloni u malim količinama preko levka i pažljivo sabija pomoću vakuuma na drugom kraju kapilare. Ako je punjenje previše gusto, kolone će se tokom upotrebe blokirati. U suprotnom, kada je punjenje nedovoljno gusto, separacija komponenti biće nepotpuna [42].
Da bi se postiglo adekvatno razdvajanje jedinjenja iz smeše, radna temperatura kolone mora se kontrolisati u rasponima od par stepeni Celzijusa. Po empirijskom pravilu ona iznosi nekoliko stepeni više od prosečne temperature ključanja uzorka. U tom slučaju, eluciono vreme se kreće od 2 do 30 minuta. Kada se odabira radna temperatura, potrebno je napraviti balans, jer se sa njenim povećanjem skraćuje vreme elucije, ali se pogoršava rezolucija. Za razdvajanje komponenata vrlo različitih tačaka ključanja, koriste se temperaturni programi, koji omogućavaju konstantne, ili periodične promene temperature tokom vremena hromatografisanja [23].
U kombinaciji tehnika GC-MS upotrebljavaju se kapilarne kolone zbog malog protoka gasa nosača i velike moći razdvajanja. U ovom radu je korištena kolona SP-2560, dužine 100 m, unutrašnjeg prečnika 0,25 mm i 0,20 μm debljine filma stacionarne faze koja nije hemijski vezana za stopljena silikatna jedinjenja,. Ova kolona omogućuje maksimalnu rezoluciju geometrijskih cis i trans i pozicionih izomera masnih kiselina [43, 44].
.
Stacionarne likvidne faze
Osnovni zahtev pri odabiru stacionarne likvidne faze je da obezbedi odgovarajući stepen selektivnosti prilikom separacije. Istovremeno, trebalo bi da poseduje hemijsku i termičku stabilnost, kao i što duži rok upotrebe. Na selektivnost utiču mnogobrojni faktori, zbog čega se preporučuje eksperimentalno određivanje ove veličine. Ipak, odlučujući uticaj ima polarnost, pa se prema tome likvidne faze dele na: nepolarne, slabo polarne, polarne i visokopolarne. Izbor likvidnih faza izvodi se na osnovu Rohrschneider/McReynolds-ovih konstanti [42].
Kod mikropakovanih kolona, polarnost je promenjiva veličina i zavisi od načina punjenja stacionarne faze, prirode inertnog nosača i operativnih uslova, kao što su temperatura i starost kolone. Sa druge strane, kod WCOT kolona, polarnost vrlo malo zavisi od debljine likvidnog sloja, pa se selektivnost može definisati sa velikom sigurnošću [42].
Kao stacionarne likvidne faze koriste se visokomolekularna jedinjenja dobijena polimerizacijom, polikondenzacijom, ili poliesterifikacijom organskih, ili silicijumovih jedinjenja [40]. Na kolonama sa likvidnim fazama od polietilen-glikola, metil-estri masnih kiselina sa 4 do 24 C atoma se mogu razdvojiti prema dužini ugljovodoničnig niza i stepenu nezasićenosti, ali se ne može postići zadovoljavajuće razdvajanje cis i trans izomera. Problemi se javljaju i kod analize složenih smeša, kao što su riblja ulja. Likvidne faze srednje polarnosti se koriste za rutinske analize biljnih ulja i životinjskih masti, kao i proizvoda koji ih sadrže (margarin, maslac, namazi, mlečna mast i slično). Kapilarne kolone sa visoko polarnim cijanosilikonskim stacionarnim fazama, sa različitim udelom cijano-propil grupa, omogućuju analizu kompleksnih smeša masnih kiselina, dobro razdvajanje metil-estara polinezasićenih ω-3 masnih kiselina i geometrijskih i pozicionih izomera, što je uslovljeno jačom interakcijom cis izomera sa cijano-dipolom, pa se tako trans oblici eluiraju pre odgovarajućih cis oblika [7].
Za razdvajanje cis i trans masnih kiselina, osim kvaliteta, važni su i debljina filma likvidne faze, kao i dužina i unutrašnji prečnik kolone [7].
Pri regularnoj upotrebi, kvalitet stacionarne faze se može pogoršati, što je obično posledica hemijskog oštećenja. WCOT kolone su osetljivije na ove promene od mikropakovanih, prvenstveno zbog manjeg sadržaja likvidne faze. Visokopolarne likvidne faze su vrlo osetljive na kiseonik i vodu, pa se preporučuje da se i najmanji tragovi ovih jedinjenja uklone iz gasa nosača. Takođe, mogu sporo reagovati sa polarnim rastvaračima (hloroform, alkohol, ugljenik-disufid, itd.) i nečistoćama ubačenim u kolonu zajedno sa uzorkom, a svaka negativna reakcija se pojačava pri povišenim temperaturama koje se postižu tokom hromatografisanja. Proticanje gasa nosača ne sme se prekidati sve dok se kolona zagreva. Najveća oštećenja pojavljuju se u prvih nekoliko namotaja kolone, u kojima likvidna faza može biti potpuno uklonjena, ili pretrpeti ozbiljne degeneracije [42].
.
Unošenje uzorka i injekcioni sistemi
Za unošenje gasovitih uzoraka koristi se gasna slavina, a za unos tečnosti, injekcioni blok, koji je ugrađen neposredno ispred kolone.
Tečni uzorak se ubrizgava mikrošpricem, tako što se iglom mikrošprica probuši gumeni zaptivač (septum), a zatim se naglim pritiskom na klip šprica potiskuje određena zapremina uzorka (0,1-10 μl) [40]. Da bi rad kolone bio optimalan, uzorak ne sme imati veliku zapreminu i treba da se uvede kao „čep“ pare. Ako se uzorci injektuju sporo i u velikim zapreminama, pojavljuje se širenje pikova, a rezolucija se smanjuje [23].
Injekcioni blok se, po empirijskom pravilu, zagreva na temperaturu koja je za oko 50˚C viša od temperature kolone, jer ona omogućava momentalno isparavanje svih komponenata iz uzorka . Grejači se napajaju električnom strujom, a regulacija i kontrola temperature se obavlja pomoću instrumenta sa otpornim termometrom [40].
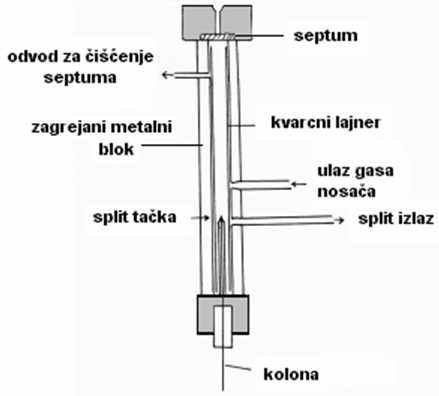
Slika 9. Šema split injektora
Kapilarne kolone imaju ograničen kapacitet i relativno je lako prepuniti ih uzorkom prevelike zapremine, ili koncentracije. Da bi se prevazišao ovaj problem, konstruisani su različiti injekcioni sistemi, a injektor sa razdeljivačem – split (slika 9) je najjednostavniji i daje odlične rezultate.
Uzorak se unosi u gas nosač, koji se deli u dve struje : manju, koja je usmerena na kolonu i veću koja se ispušta u atmosferu. Količina uzorka koja se unosi u kolonu regulisana je igličastim ventilom (restriktorom), postavljenog u vod za ispiranje (split izlaz), a odnos razdeljivanja dve struje ( Split Ratio-SR ) kreće se od 20:1 do 200:1 .
Izraz za izračunavanje ovog odnosa glasi :
Qkol – protok kroz kolonu
Qs.v. – protok kroz vod za ispiranje
Osnovna mana ovog injektora je to što se uzorci viših tački topljenja ne unose kvantitativno u kolonu. Da bi se dobili što tačniji rezultati, prirodu rastvarača i njegovu zapreminu treba održavati konstantnom, iglu ubadati uvek u istu tačku injektora, a početnu temperaturu kolone precizno reprodukovati.
Pored opisanog injektora, dobre rezultate daju i splitless sistem injektovanja i takozvani sistem „on-column“, koji podrazumeva direktno unošenje uzorka u kolonu, ali kako ovi sistemi nisu korišteni u radu, neće biti detaljnije opisivani [42].
Spisak korišćene literature možete naći u Literatura – Analiza hrane.