Autor: mr Dobrila Ranđelović
e-mail : dobrilarandjelovic@beotel.net
.
Hemijski sastav voća je složen i zavisi od više faktora među kojima su pored vrste i sorte, veoma bitni klimatski uslovi, pedološke osobine zemljišta, primenjene agrotehničke mere, stepen zrelosti i dr.
Hemijski sastav voća je od značaja i sa gledišta ishrane i sa gledišta tehnologije. Koji tehnološki postupak će se primeniti, koje reakcije mogu da se očekuju tokom prerade, i kakav proizvod će se dobiti, tesno je vezano sa sastavom sirovine.
Najvažnije komponente hemijskog sastava voća su: voda, ugljeni hidrati, kiseline, bojene materije, aromatične, pektinske, mineralne materije, vitamini, proteini itd.
Voda je neophodna za odvijanje metabolizma u svim ćelijama biljaka, životinja i čoveka. U zavisnosti od vrste i uslova gajenja voće može da sadrži od 75 do 93% vode. U tabeli 1. prikazan je prosečan sadržaj vode u voću.
Tabela 1. Prosečan sadržaj vode (%) u voću (Blagojević, 2000)
| VRSTA VOĆA | SADRŽAJ VODE (%) |
| Grožđe | 79 |
| Breskva | 80 |
| Šljiva | 80,4 |
| Trešnja | 81,7 |
| Kruška | 83 |
| Jabuka | 83 |
| Malina | 85 |
| Kupina | 85 |
| Kajsija | 86 |
| Jagoda | 92 |
.
Tako visok sadržaj vode smanjuje energetsku, ali pruža visoku fiziološku vrednost. Zahvaljujući tome što su nutritivno vredne supstance voća (šećeri, kiseline, deo pektinskih materija, neke bojene materije, pojedini vitamini i minerali) vodeni rastvori, organizam čoveka ih lako usvaja.
Bez obzira na svu važnost vode, u tehnologiji se govori o sadržaju suve materije, dakle svega onoga što nije voda a što se nalazi u voću.
Suva materija se sastoji od rastvorljivih (šećeri, kiseline i druge rastvorljive materije) i nerastvorljivih materija (skrob, celuloza, hemiceluloza, protopektin i dr.). Stalni nadzor i uvid u sadržaj suve materije u sirovini pruža jasna i određena uputstva za usmeravanje i vođenje tehnološkog postupka.
Ugljeni hidrati su posle vode najzastupljeniji sastojci. Zajedno sa kiselinama oni predstavljaju osnovnu komponentu u formiranju ukusa proizvoda. U tabeli 2. predstavljen je sadržaj šećera i kiselina u voću.
Tabela 2 . Sadržaj šećera i kiselina u voću (Niketić-Aleksić, 1988)
| Vrsta voća | Sadržaj invertnog šećera u % |
Sadržaj saharoze u % | Sadržaj ukupnog šećera u % | Ukupne kiseline % | pH | Koeficijent slasti šeć/kis. |
| Jabuka | 6,8 | 2,1 | 6,6-15,5 | 0,4-0,8 | 3,6 | 9-28 |
| Kruška | 8,1 | 1,9 | 8,3-15,4 | 0,2-0,5 | 4,0 | 23-42 |
| Dunja | 7,2 | 0,9 | 5,8-12,5 | 0,6-1,0 | 3,3 | 9-18 |
| Kajsija | 4,1 | 2,2 | 6,4-12,6 | 0,6-1,1 | 3,4 | 4-15 |
| Breskva | 3,5 | 4,2 | 5,0-12,0 | 0,5-0,7 | 3,6 | 9-16 |
| Šljiva | 8,2 | 1,8 | 7,0-15,5 | 0,5-0,7 | 3,6 | 6-28 |
| Višnja | 7,8 | 0,6 | 6,9-12,5 | 0,8-1,9 | 3,3 | 3-8 |
| Trešnja | 8,4 | 0,4 | 4,7-11,5 | 0,3-0,6 | 3,9 | 11-25 |
| Malina | 4,5 | 0,2 | 4,7-9,5 | 0,8-2,0 | 3,4 | 3-5 |
| Kupina | 6,2 | 0,9 | 6,0-9,0 | 0,80 | 3,5 | 6-8 |
| Jagoda | 3,8 | 1,7 | 4,5-7,8 | 0,50 | 3,5 | 4-10 |
| Grožđe | 20,5 | / | 15-25 | 0,5-0,9 | 3,5 | 18-50 |
| Limun | 3,1 | 0,3 | 1,5-4,0 | 3-7 | 2,5 | 0,3-0,9 |
| Pomorandža | 5,8 | 3,9 | 5,6-13,5 | 0,7-1,2 | 3,4 | 8-17 |
| Borovnica | 4-6,5 | 0,2-0,8 | 4,0-7,0 | 0,8-1,2 | 3,4 | 5-9 |
| Crna ribizla | 8,1 | / | 6,1-13,3 | 3,3 | 3,3 | 2-3 |
.
Po tome da li sadrže aldehidnu ili keto grupu šećeri se mogu svrstati u aldoze (glukoza) i ketoze (fruktoza). Neki šećeri se javljaju kao samostalni i tada se zovu monosaharidi (glukoza, fruktoza). Monosaharidi se odlikuju osobinom sjedinjavanja s drugim supstancama koje sadrže OH-grupe. Tako dobivena jedinjenja su glikozidi (ili potpunije,O-glikozidi).
Glikozidi su jedinjenja koja postaju sjedinjavanjem nekog monosaharida sa nekim od sledećih jedinjenja: alkoholima, fenolima, flavonima, karotenima pa i sa samim šećerima. Ugljeno hidrantni deo glikozida naziva se glikon a neugljenohidrantni (nešećerni) aglikon. Glikozidi nastali sjedinjavanjem dva monosaharida su disaharidi (saharoza, maltoza, laktoza). Ukoliko se više istih monosaharida poveže u niz govorimo o homopolisaharidima (skrob, celuloza) a kada se polimerizuju različiti monosaharidi, stvaraju se heteropolisaharidi (arabinoksilan, arabinogalaktan, glukomanan i dr.).
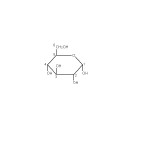
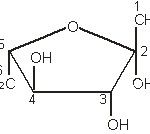
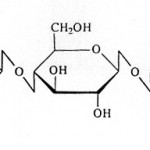
Najvažniji šećeri voća su glukoza, fruktoza i saharoza. d-glukoza (slika 1) (dekstroza, grožđani šećer) je monosaharid, koja se u sirovini nalazi ne samo slobodna već i vezana kao deo oligosaharida, polisaharida i mnogih drugih organskih jedinjenja. Glukoza se lako vezuje za druge nešećerne materije (proteini, masti i dr.).
d-fruktoza (slika 2) (levuloza, voćni šećer) se, kao i glukoza, nalazi u znatnim količinama u voću. Ona je prisutna u slobodnom i vezanom stanju, odnosno kao sastojak složenih šećera: disaharida saharoze, trisaharida rafinoze i u polisaharidu inulinu.
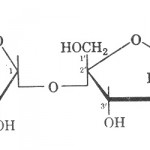
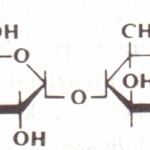
Saharoza (slika 3) je disaharid sastavljen od molekula glukoze i fruktoze. U vodi se vrlo lako rastvara. Ne redukuje Felingov rastvor. Podleže vrlo brzoj hidrolizi pomoću kiselina. To je važan disaharid ne samo kao energetska i organoleptička materija već i kao konzervans, ukoliko se nalazi u određenoj koncentraciji.
Skrob (C6H10O5)n je polisaharid. To je proizvod asimilacije biljaka koje ga sintetizuju iz ugljen-dioksida i vode u prisustvu hlorofila kao katalizatora i sunčeve svetlosti.
Nagomilava se kod mladih ćelija, dok ga zreli plodovi sadrže u manjim količinama (pri sazrevanju hidrolizuje).
Polisaharidi skroba se mogu razdvojiti na dve frakcije: amilozu (slika 4) (sadrži jednostavni lanac ostatka glukoze) i amilopektin (slika 5) (sadrži višestruki razgranati lanac ostatka glukoze).
Odnos između amiloze i amilopektina u skrobovima raznih biljaka je takođe različit. Kod jabuke je taj odnos: amiloza 30%, amilopektin 70% (Džamić, 1984).
Celuloza (slika 6) je glukan, ali su molekuli glukoze povezani β glikozidnim vezama.
Celuloza predstavlja osnovnu supstancu zidova ćelija viših biljaka gde se nalazi zajedno sa drugim polisaharidima (hemiceluloza, pektini i dr.) (slika 7).
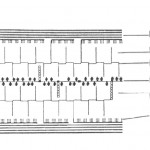
Struktura ćelijskog zida 1. celuloza; 2. arabani, ksilani; 3. pektin; 4. protein; 5. arabino galaktan; 6. ksiloglukan
Plod kupine sadrži oko 4 % celuloze (Mratinić, 1998). Kako se celuloza ne razgrađuje u organima za varenje, izbacuje se iz organizma povlačeći sa sobom toksične materije. Zato celuloza u nutritivnom smislu postaje osnova fiziološki vrednih biljnih vlakana koji pospešuju peristaltiku creva.
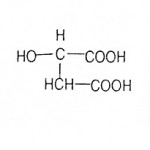
Kiselost voća potiče od organskih kiselina i njihovih kiselih soli. Najzastupljenije kiseline su jabučna, limunska i vinska (slika 8). U manjim količinama su zastupljene oksalna, hlorogena, kafe, salicilna, benzoeva, mravlja i dr.
U raznim vrstama voća dominantne su različite kiseline. Tako je limunska kiselina dominantna u citrusima (limun, narandža), jabučna u jabučastom, koštičavom i jagodastom voću, a vinska u bobičavom voću.
Procentualni sadržaj svih prisutnih kiselina u voću se definiše kao titracioni aciditet, a kiselost definisana koncentracijom vodonikovih jona kao aktuelni aciditet izražen kao pH. Vrednost pH služi često i kao merilo zrelosti voća.
Za kiselo voće pH se kreće od 2,5-3,5, za srednje kiselo od 3,5-4,5 (Vračar, 2001).
Mineralne materije u svežem voću (tabela 3) nalaze se najčešće u granicama od 0,3-0,8%. Kao redovni sastojci nađeni su: kalijum, kalcijum, magnezijum, gvožđe, mangan, natrijum, fosfor, sumpor, zatim u manjim količinama bakar, fluor, cink, jod i dr (Niketić-Aleksić, 1988).
Najzastupljeniji elementi u voću su kalijum i natrijum (alkalni metali), zatim dolaze kalcijum i magnezijum (zemnoalkalni metali). Njih ima najviše u zemljištu, pa time i u plodu biljke radi čega se i zovu makroelementi. Tu spada i fosfor kao ključni element za prenos energije kroz ćeliju tokom metabolizma.
Posebno značajnu ulogu imaju mikroelementi (gvožđe, bakar, jod, fluor, cink…), kojih ima vrlo malo, ali služe u biljci (i kod čoveka) kao važni kofaktori za aktivnost enzima.
Mineralne materije su u poređenju sa drugim sastojcima voća stabilne, ne menjaju se tokom čuvanja, kao ni pri procesu konzervisanja.
Kalijum reguliše alkalitet u ćeliji, a natrijum van ćelije. Njihov međusobni odnos reguliše krvni pritisak u organizmu čoveka. Povećanje sadržaja kalijuma snižava telesni pritisak, dok ga natrijum povišava. Zato ljudi sa hipertenzijom unose voće bogato kalijumom. Kalcijum je važan za pravilnu kalcifikaciju kosti i zuba.
Magnezijum je sastavni deo hlorofila biljke, a kod čoveka stimuliše stvaranje krvnih zrnaca, reguliše krvni pritisak, smanjuje holesterol u krvi, sprečava arterosklerozu i pothranjenost (Zlatković, 2003).
Tabela 3. Prosečan sastav mineralnih materija u voću (mg/100g) ( Zlatković, 2003)
| VOĆE | KALIJUM | NATRIJUM | KALCIJUM | MAGNEZIJUM |
| Kajsija | 305 | 30 | 28 | 19 |
| Breskva | 363 | 30 | 20 | 16 |
| Jabuka | 248 | 26 | 16 | 9 |
| Kruška | 155 | 14 | 19 | 12 |
| Višnja | 256 | 20 | 37 | 26 |
| Šljiva | 214 | 18 | 28 | 17 |
| Grožđe | 255 | 26 | 30 | 17 |
| Jagoda | 161 | 18 | 40 | 18 |
| Kupina | 260 | 23 | 22 | 9 |
| Malina | 224 | 10 | 40 | 22 |
| Crna ribizla | 350 | 32 | 36 | 31 |
.
Aromatične materije su odgovorne za miris, a pretežnim delom i za ukus voća. Ove materije se u voću nalaze u minimalnim količinama, lako su isparljive i veoma lako reaguju međusobno ili sa nekim drugim materijama. U hemijskom pogledu arome voća predstavljaju smešu raznih alkohola, estara, aldehida, ketona, karbonskih kiselina, eteričnih ulja, smola i voskova. Uljane frakcije aroma sadrže više masne kiseline i terpene (Šulc i sar.,1976).
U pojedinim sirovinama se nalaze u različitim odnosima i međusobnim kombinacijama a variraju po sadržaju, rastvorljivosti i isparljivosti i tek kao celina daju odgovarajuću aromu.
Bojene materije se dele u dve grupe:
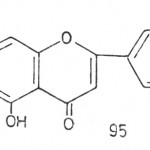
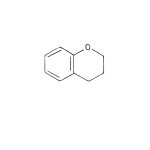
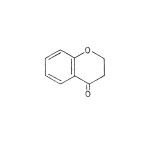
Ugljenikov skelet flavonoida sastoji se iz dva benzenova prstena koja su međusobno vezana tročlanim alifatičnim nizom (C6-C3-C6 jedinjenja). Po hemijskoj strukturi flavonoidi su heterociklična jedinjenja (slika 10) koja se mogu izvesti iz hromana (slika 11) ili hromona (slika 12).
U prirodi se flavonoidi nalaze u obliku glikozida ili estara s taninskim kiselinama. Zato se, za razliku od karotinoida, koji su takođe žute boje, flavonoidi iz prirodnog materijala ekstrahuju vodom ili još bolje 0,1M hlorovodoničnom kiselinom.
Antocijani (anthos-cveće, kyanos-plav) su prirodne boje, od crvene do plave, koje je izolovao Marguart 1835. godine. Nalaze se u cvetnim laticama i drugim delovima viših biljaka. Neke od ovih pigmenata izolovao je R.M.Willstatter početkom XX veka (za svoj doprinos dobio je Nobelovu nagradu 1915.god.). Willstatter je otkrio da skoro svo voće i cveće crvene, plave i purpurne boje sadrži antocijane. Ovih pigmenata ima u voću (kupine, maline, borovnice trešnje, grožđe, jabuke, šljive…), povrću (crveni kupus, plavi patlidžan, rotkvice..) (Jeličić i dr.,2005).
Ova jedinjenja se u biološkim sistemima ponašaju kao antioksidanti, enzimski inhibitori, fotosenzibilizatori i prenosioci energije, respiratori u biosintezama, takođe pokazuju i antikancerogene osobine. Ispostavilo se da su antocijani veoma korisni u kontroli nivoa šećera u krvi, kao zaštitnici od koronarnih bolesti, takođe ublažuju rizik od Alchajmerove bolesti. Kupine, zajedno sa borovnicama su na mestu broj jedan po antioksidujućem dejstvu. Polovina šoljice kupinovog soka ima u sebi toliko antioksidativnog dejstva koliko pet porcija nekog drugog voća i povrća (npr. šargarepa, jabuka) (Jeličić i dr., 2005).
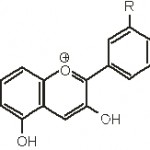
Javljaju se u obliku glikozida (najčešće kao 3-glikozidi). Pigmenti bez šećerne komponente nazivaju se antocijanidini (slika 13) i nerastvorni su u vodi. Utvrđeno je da pet šećera učestvuju u hemijskoj strukturi antocijana (glukoza, ramnoza, galaktoza, ksiloza, arabinoza).
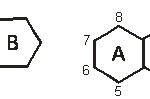
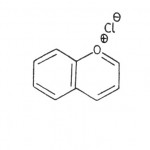
Ako neki od antocijana sadrži samo jedan od šećera onda se ovaj nalazi u položaju 3, ako sadrži dva, onda je ili diglikozid u položaju 3 ili se šećerne komponente nalaze u položajima 3 i 5. U sastav nekih antocijana ulaze i jedan ili više molekula organskih kiselina (p-kumarna, kofeinska, malonska, sirćetna) esterifikovanih s molekulom šećera. Antocijanidini se izvode iz hromana i po hemijskoj strukturi su derivati benzopirilijum (flavilium) – hlorida (slika 14). Svi antocijanidini sadrže 3,5,7-trihidroksi-flavilijum – jon (slika 15).
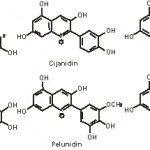
| NAZIV | R | R’ |
| Pelargonidin | H | H |
| Cijanidin | OH | H |
| Delfinidin | OH | OH |
| Peonidin | OCH3 | H |
| Petunidin | OH | OCH3 |
| Malvidin | OCH3 | OCH3 |
Boja antocijana zavisi i od broja hidroksilnih grupa u prstenu B. Tako je na primer pelargonidin oranž-crvene boje, cijanidin zatvoreno crven a delfidin ljubičaste boje. Metilovanjem hidroksilnih grupa u B prstenu povećava se intezitet boje.
Neki važniji antocijani su prikazani u tabeli 4.
Tabela 4. Antocijani
| Antocijan | Glikozid | Aglikon | Po nomenklaturi | Gde se nalazi |
| Pelargonin | 3,5-diglikozid | Pelargonidin | 3,5,7,4’-tetraoksi flavilijum hlorid | Dahlia |
| Cijanin | 3,5-diglikozid | Cijanidin | 3,5,7,4’-pentaoksi flavilijum hlorid | Kupina Ljubičica Ruža |
| Violanin | 3-ramnoglikozid | Delfinidin | 3,5,7,3’,4’,5’-heksaoksi flavilijum hlorid | Ljubičica |
| Peonin | 3,5-diglikozid | Peonidin | 3,5,7,4’-tetraoksi -3’-metoksi flavilijum hlorid | Peonija |
| Petonin | 3,5-diglikozid | Petunidin | 3,5,7,4’,5’-pentaoksi -3’-metoksi flavilijum hlorid | Plavo grožđe |
| Oenin | 3-glikozid | Malvidin | 3,5,7,4’-tetraoksi -3’,5’-dimetoksi flavilijum hlorid | Primula |
Cijanidin-3-glukozid je dominantan pigment kod kupine (Dugo et al., 2001; Garcia-Viguera et al., 1997). Slika 16. predstavlja identifikovane antocijane u kupini HPLC/ESI-MS metodom (Dugo et al., 2001).

HPLC-UV hromatogram u ekstraktu kupine: 1. cijanidin-3-galaktozid; 2. cijanidin-3-glukozid; 3. cijanidin-3-arabinoza; 4. pelargonidin-3-glukozid; 5. cijanidin-3-ksiluloza; 6. malvidin-3-glukoza
Jedna od najvažnijih osobina antocijana je što kiseonik u heterocikličnom prstenu ima pozitivno naelektrisanje. Zato se u kiseloj sredini antocijani ponašaju kao katjoni koji grade soli sa kiselinama, a u alkalnoj sredini su anjoni i grade soli sa bazama.
Mnogi činioci, kao što su pH sredine, SO2, L-askorbinska kiselina, prisustvo jona metala, povećan sadržaj šećera, aktivnost enzima, temperatura i dr., utiču na boju antocijana (Janković i sar.,1991).
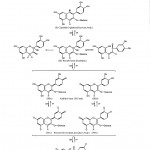
Jedna od značajnih osobina antocijana kao obojenih materija, je da se boja jedinjenja menja sa promenom pH vrednosti, i to od crvene u kiseloj sredini (pH<6) preko bezbojne u slabo kiseloj sredini (6 <7), do plave boje u neutralnoj ili alkalnoj sredini (pH>7). Na primer, kod cijanidin-3-glikozida, transformacije boje su posledice promene strukture (slika 17).
Struktura cijanidin-3-glukozida (slika 17, I) egzistira u kiseloj sredini i pokazuje crvenu boju; u slabo kiseloj sredini struktura se menja u bezbojan oblik pseudo baze ili karbinol baze (slika 17, II) i u ravnoteži je sa anhidro bazom (slika 17, IIIa, IIIb), u kojoj se gubi molekul vode, i nastaje nestabilan oblik koji apsorbuje svetlost talasne dužine od 538 nm. U alkalnoj sredini fenolne grupe se jonizuju sa formiranjem fenolata koji su stabilniji od nedisosovane baze (slika 17, IVa, IVb) i nastajanjem plave boje. Na kraju, pri pH 12 plava boja se menja u zelenu ili žutu što ukazuje na nastajanje čalkona (slika 17, V) (Milić i dr., 2000).
Utvrđeno je da se antocijani mogu redukovati, ali mehanizam redukcije nije još poznat. Cink, aluminijum, magnezijum u kiseloj sredini obezbojavaju rastvor antocijana. Obezbojavanje je postojanije ako se reakcija odvija bez prisustva vazduha zato što kiseonik iz vazduha pomaže da se boja antocijana vrati (Milić i dr., 2000).
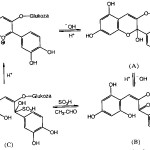
Obezbojavanje antocijana je moguće alkalnim bisulfitima (slika 18).
U slabo kiseloj sredini u prisustvu bisulfita, bezbojna forma reaguje (slika 18, A) kao čalkon forma (slika 18, B), koja sadrži keto funkcionalnu grupu u položaju C2 uz nastajanje adicionog bisulfitnog derivata (slika 18, C) iz koga se u kiseloj sredini reakcija vraća u polazni antocijan (Milić i dr., 2000).
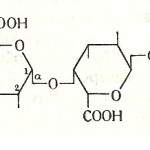
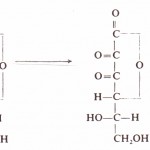
Pektinske materije nalaze se samo u biljkama skoro u svim njihovim delovima (stablo, krtola, koren, plod) gde imaju važnu biohemijsku i fiziološku funkciju. Skeletna osnova pektinskih materija predstavlja poligalakturonska kiselina (slika 19). Poligalakturonska kiselina je polimer D-galakturonske kiseline, međusobno povezanih 1,4-α-galaktozidnom vezom.
Klasifikacija pektinskih materija je sledeća: protopektin, pektininska kiselina, pektinske kiseline i pektin.
Pektinske materije se nalaze široko rasprostranjene u voću i povrću i to pretežno u središnjoj lameli biljnih ćelija, a manje u ćelijskom zidu. Sadržaj pektinskih materija u svežem voću i povrću se kreće: 0,1 – 0,5 % u paradajzu, 0,4% u kupini, 0,5 – 1,9 % u jabuci, itd., (Vračar, 2001).
Vitamini predstavljaju grupu organskih jedinjenja raznovrsne strukture i hemijskih osobina čija je funkcija u organizmu specifična i neophodna.
Za većinu vitamina poznat je način njihove katalitičke uloge u biohemijskim reakcijama dok za neke vitamine nije poznat način dejstva ali su poznate posledice koje se javljaju kao nedostatak ovih jedinjenja u hrani.
Nedovoljan unos pojedinih vitamina dovodi do bolesti koje se nazivaju hipovitaminoze. Ako je nedostatak jako izražen, simptomi bolesti su još teži. Tada se govori o avitaminozi (Lajšić, 1983).
Pošto su vitamini heterogena grupa organskih jedinjenja ne mogu se klasifikovati na osnovu hemijske strukture. Izdvojena su u posebnu klasu jedinjenja na osnovu fiziološkog dejstva.
Vitamini se prema rastvorljivosti svrstavaju u dve velike grupe:
Vitamini su veoma značajni sastojci voća (tabela 5) i u kombinaciji sa mineralnim materijama čine ih fiziološki veoma vrednim. Iz tih razloga, zadatak svakog tehnološkog procesa je da ih sačuva u najvećoj mogućoj meri (Vračar, 2001).
Tabela 5. Sadržaj vitamina nekih vrsta voća (mg/100g)
( Vračar, 2001).
| Vrsta voća | B1 tiamin | B2 riboflavin | B3 niacin | C L-askorbinska kiselina |
| Jabuka | 0,03 | 0,02 | 0,3 | 10,0 |
| Kruška | 0,02 | 0,04 | 0,22 | 4,0 |
| Dunja | 0,03 | 0,03 | 0,2 | 13,0 |
| Kajsija | 0,04 | 0,05 | 0,77 | 10,0 |
| Breskva | 0,02 | 0,05 | 0,85 | 8,0 |
| Šljiva | 0,08 | 0,04 | 0,5 | 6,0 |
| Višnja | 0,05 | 0,06 | 0,4 | 12,0 |
| Jagoda | 0,03 | 0,05 | 0,6 | 50,0 |
| Malina | 0,02 | 0,05 | 0,3 | 20,0 |
| Kupina | 0,03 | 0,04 | 0,4 | 21,0 |
| Crna ribizla | 0,05 | 0,04 | 0,28 | 200 |
.
Vitamin C je po hemijskoj strukturi 2-okso-L-treo-heksono-1,4-lakton-2,3-en-diol a po nomenklaturi L-askorbinska kiselina (slika 20). Ovaj vitamin se u prirodi nalazi u obliku dehidroaskorbinske kiseline (slika 20). Naročito ga ima u šipku, paprici, kupusu, spanaću, citrus plodovima.
Fiziološko dejstvo askorbinske kiseline ogleda se u učestvovanju u oksido redukcionim procesima metabolizma ćelije. Proces oksidacije askorbinske kiseline katalizovan je enzimima i jonima metala. Dokazano je da vitamin C može da učestvuje u transformaciji aminokiselina, na primer, u metabolizmu tirozina ili hidroksilovanju prolina.
Vitamin C u kristalnom stanju izolovali su King i Wang 1932.godine. Dobro se rastvara u vodi a slabo u alkoholu. Vodeni rastvor (0,1 M) ima pH 2,2.
Askorbinska kiselina je vrlo reaktivno jedinjenje i brzo se oksiduje u dehidroaskorbinsku kiselinu. Razgrađuje se u neutralnoj i alkalnoj sredini, a i pod uticajem svetlosti. Na sobnoj temperaturi, askorbinska kiselina redukuje Feling-ov rastvor, permanganat i srebro-nitrat pri čemu prelazi u dehidro-oblik (Lajšić, 1983).
Proteini su polimeri aminokiselina. Reakcijom između aminokiselina nastaju peptidne veze. Kada se sjedine više aminokiselina nastaje polipeptid.
Redosled aminokiselina u nizu (primarna struktura proteina) određen je šifrom koju ćelija nosi zapisanu u svom genetskom materijalu (DNK). To omogućava ćeliji da sintetiše proteine iste strukture kad god je potrebno.
U polimerizaciji do proteina učestvuje svega dvadeset aminokiselina. Sa stanovišta ishrane značajno je podsetiti da su osam od njih esencijalne (nezamenljive – čovek ih ne sintetiše). Voće je u principu siromašno proteinima. Izuzetak od ovog pravila je jezgrasto voće (tabela 6).
Tabela 6. Prosečan sadržaj proteina u voću
( Zlatković, 2003).
| VRSTA VOĆA | SADRŽAJ (%) |
| Jabuka | 0,3 |
| Kruška, ananas | 0,5 |
| Breskva, limun | 0,8 |
| Šljiva, jagoda, grožđe | 0,8 |
| Orah, badem, lešnik | 15 |
| Pomorandža, kajsija | 0,9 |
| Kupina | 1,2 |
| Banana, malina | 1,3 |
| Ribizla | 1,4 |
| Avokado | 2,1 |
.
Literatura
1. Lajšić, S., Grujić, B.: Hemija prirodnih proizvoda,Niš (1983)
2. Džamić, M.: Biohemija, Beograd (1984)
3. Niketić-Aleksić, G.: Tehnologija voća i povrća, Beograd (1988)
4. Garcia-Viguera, C., Zafrilla, P., Tomas-Barberan, F.: Determination of Authenticity of Fruit Jams by HPLC Analysis of Anthocyanins ( 1996)
5. Todorović, M., Đurđević, P., Antonijević, V.: Optičke metode instrumentalne analize, Beograd (1997)
6. Mratinić, E.: Kupina,Novi Beograd (1998)
7. Milić, B., Đilas, S., Brunet-Čanadanović, J., Sakač, M.: Biljni polifenoli,Novi Sad (2000)