Autor: dipl. ing. Dušica Ivanov
Mentor: prof. dr Nikola Marjanović
Maseni spektri nastaju razdvajanjem jona, dobijenih iz molekula, po odnosu njihove mase prema naelektrisanju, m/z. Najveći broj jona poseduje samo jedno naelektrisanje, z=1, pa je vrednost m/z jednaka molekulskoj (jonskoj) masi. Zbog toga se odnos m/z naziva „masa“. Pošto su molekuli veoma mali, izražavanje mase u kilogramima, ili gramima nije podesno, pa se koriste druge jedinice. U hemiji i biohemiji koristi se Dalton (Da), koji se definiše kao 1/12 mase atoma ugljenikovog izotopa C12 [7, 23].
Maseni spektrometar je instrument koji omogućava određivanje ispitivane komponente na osnovu masenog spektra. Uzorak se jonizuje, a obrazovani joni uobičajeno razdvajaju dejstvom električnog i/ili magnetnog polja i registruju prema masi i količini.
Najvažniji delovi aparature su: sistem za unošenje uzorka (veza GC-MS), jonski izvor, maseni analizator i detektor. Da bi formirani joni na svom putu od jonskog izvora do detektora izbegli sudare sa drugim česticama sistem se nalazi pod visokim vakuumom, pritiska ispod 10-6 mbar. Nekontrolisani sudari mogli bi da izazovu dalje reakcije jona, interferencije bi bile velike, pa samim tim, maseni spektri neadekvatni [7, 23].
.
Maseni spektar
Kao rezultat maseno-spektrometrijskih merenja dobija se grafik zavisnosti inteziteta struje pojedinačnih jona (abundance) od m/z vrednosti. Ovaj grafik naziva se maseni spektar. Iz njega se mogu dobiti sledeće informacije, bitne za određivanje strukture nepoznatog jedinjenja:
1) Koji su joni prisutni u uzorku
2) Kako su nastali pojedini joni
3) U kojim se međusobnim odnosima nalaze koncentracije tih jona
Maseni spektri uobičajeno sadrže sledeće vrste jona:
1) Molekulski joni, čija masa predstavlja molekulsku masu jedinjenja koje se isputuje
2) Fragmentni joni, koji nastaju usled raskidanaja pojedinih veza u molekulskom jonu
3) Preuređeni joni, koji nastaju premeštanjem jednog ili grupe atoma iz jednog jona u drugi
4) Metastabilni joni, (pikovi su im razvučeni i slabog inteziteta)
.
Vezivanje GC i MS (transferline)
Problem razlike pritisaka prilikom direktnog vezivanja MS za GC nekada je prevazilažen upotrebom separatora. Zadatak ovih uređaja bio je uklanjanje malih molekula (atoma) gasa nosača iz eluata i propuštanje veće količine krupnijih organskih molekula u jonski izvor. Pri tome je dolazilo do gubitaka analita u velikoj količini [23].
Sa upotrebom kapilarnih kolona problem je nestao jer je omogućeno direktno vezivanje, to jest uvođenje analita direktno u jonski izvor MS. Celokupna količina analita, u ovom slučaju, dolazi u MS, što je naročito značajno kada se analiziraju supstance čije su koncetracije u uzorku izuzetno male [23]. Interfejs mora biti inertan i na njemu ne bi trebalo da ima hladnih tačaka, da bi se izbegla kondezacija uzorka [45].
Direktno vezivanje pokazuje niz nedostataka. Protok gasa nosača u jonskom izvoru nije konstantan, jer zavisi od dimenzija kolone i temperaturnog programa. Retenciona vremena dobijena upotrebom klasičnih detektora ne mogu se porediti. Izbor kolone prema veličini i optimalni protok ograničeni su na maksimalni protok pri kojem MS može da radi, a pri zameni kolone aparat se mora isključiti [23].
.
Jonski izvor
Uloga jonskog izvora je da molekule uzorka prevede u jone, čiji sastav odgovara sastavu ispitivane supstance. S obzirom na to da je većina jonizatora dizajnirana za rad sa gasovima, molekuli se prevode u gasovito stanje. Ako su uzorci u gasovitom stanju visokog napona pare, unose se direktno u jonski izvor. Tečnosti i čvrste materije se obično predhodno zagrevaju, da bi im se povećao napon pare za analizu. Ako je analit termolabilan, ili nema dovoljan napon pare, mora se jonizovati direktno iz kondezovane faze. Ovakva jonizacija zahteva specijalne uređaje i mnogo je komplikovanija za upotrebu. Komercijalni uređaji koriste direktnu kondezaciju pri rutinskim analizama proteina i polimera sa molekulskom masom većom od 100000 Da [39].
Uobičajene jonizacione tehnike koje se danas koriste su:
1) Jonizacija elektronima (EI – electron ionization)
2) Hemijska jonizacija (CI – chemical ionization)
3) Bombardovanje brzim atomima i (FAB – fast atom bombardment)
4) Jonizacija potpomognuta laserskom desorpcijom iz matriksa (MALDI – Matrix Assisted Laser Desorption Ionization)
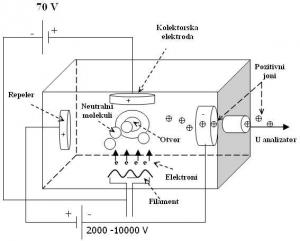
Najčešće korištena jonizaciona tehnika u masenoj spektrometriji je jonizacija elektronima (slika 10). Vrlo je uspešna za mnoge gasovite molekule, ali ima i određena ograničenja. Ovaj tip jonizacije prouzrokuje nastanak velikog broja jona, pa se molekulski jon, koji je slabog inteziteta, teško identifikuje. Međutim, ostali joni daju dodatne podatke o strukturi samog molekula.
Slika 10. Šema elektronskog jonizatora
Elektroni koji se koriste za jonizaciju nastaju propuštanjem struje kroz filament od volframa, kao katode na jednoj i anodne ploče na drugoj strani. Količina propuštene struje kontroliše broj elektrona emitovanih sa filamenata. Električno polje ubrzava elektrone dok prolaze kroz jonizator, usmerava ih i povećava im energiju. Normalno na električno polje, deluje permanentni magnet. Rezultanta dejstva dva polja uzrokuje helikoidalno kretanje elektrona. Kada molekuli analita prođu kroz ovakav elektronski mlaz, prelaze u jone.
Jonizovani molekuli ne nastaju privlačenjem elektrona. EI obrazuje pozitivne jone izbijanjem valentnih elektrona iz molekula analita, na šta naročito utiče molekulska struktura. Dok elektron prolazi pored molekula, usled njegovog naelektrisanja narušava se elektronski oblak oko molekula, on predaje kinetičku energiju oblaku, a ukoliko je predata energija dovoljna, molekul odbacuje valentni elektron i formira se katjon (M+).
Jonizacija se odvija pri energiji elektrona od 50 do 70 eV. Formirani joni se potiskuju iz jonskog izvora i odlaze u maseni analizator. Na tom putu se ubrzavaju električnim poljem napona od 2000 do 10000 V. Da bi dobijeni maseni spektri bili ujednačeni, jonski izvor mora biti čist i konstantne radne temperature, a treba voditi računa i o protoku gasa nosača (izbegavati promene protoka) [23].
.
Maseni analizator
Ovaj uređaj razdvaja nastale jone na osnovu vrednosti njihovog m/z odnosa. Selektivnost masenog analizatora zavisi od rezolucije, opsega molekulskih masa i brzine snimanja spektra. Odabir instrumenta zavisi od zahtevnosti analize, a izvodi se na osnovu navedenih karakteristika.
Rezolucija ili moć razdvajanja, R, definiše se kao najmanja razlika masa, koje se još uvek mogu razdvojiti. Praktično se izračunava na osnovu dimenzija snimljenog pika prema sledećem izrazu:
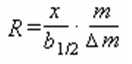
m – nominalna masa merenog pika
Δm – razlika masa izmađu dva pika
x – rastojanje između maksimuma pikova
b1/2 – širina pika na polovini visine
Iz praktičnih razloga u upotrebi je manje precizna definicija rezolucije, koja se naziva još i definicija udoline. Prema njoj su dva susedna pika razdvojena, ako je visina udoline između njih manja od 10% zbira visine pikova. U kvantitativnoj analizi ova veličina se ne može koristiti, ali se primenjuje u organskoj hemiji i sličnim oblastima u MS, jer doprinos jednog pika intenzitetu susednog, u ovom slučaju, ne utiče mnogo na rezultate [46].
Maseni analizatori se dele na kontinualne i pulsne. U kontinualne spadaju kvadrupolni i magnetni, a u pulsne jon trap analizator, analizator na bazi vremena preleta, sa dvostrukim fokusiranjem i drugi. Najčešće se koristi kvadrupolni, koji je upotrebljen i u ovom radu zbog pogodnih dimenzija, velike brzine snimanja spektra, visoke efikasnosti transmisije (broj jona koji stigne do detektora), umerenog vakuuma (p≈10–4 mbar) i niske cene [39].
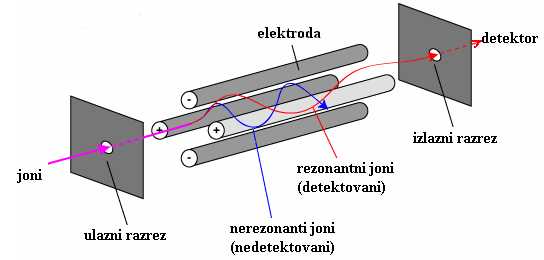
Kvadrupolni analizator (slika11) se sastoji od četiri međusobno paralelne elektrode, kojima se saopštava osnovni potencijal, definisan izrazom:
± Φ = U + V cos ωt
Φ – osnovni potencijal
U – jednosmerni potencijal
V – amplituda naizmeničnog potencijala
ω – frekvencija naizmeničnog potencijala
t – vreme
Osnovni potencijal dve susedne elektrode je istog inteziteta, ali različitog predznaka. Dok prolaze kroz analizator, joni se filtriranju na osnovu m/z vrednosti, tako da samo pojedini bivaju propušteni, jer imaju stabilnu putanju (kreću se stojećim trodimenzionalnim talasima), dok su ostali razelektrisani na elektrodama. m/z vrednost jona koji će proći kroz analizator, zavisi od U, V i ω vrednosti [39].
Radio frekventni potencijal odbija, ili prenosi jone na osnovu m/z vrednosti, fokusirajući ih naizmenično u različitim ravnima. Za vreme prve polovine radiofrekventnog ciklusa, gornja i donja elektroda su pozitivno, a leva i desna negativno naelektrisane. Ovakav raspored naelektrisanja potiskuje pozitivne jone u horizontalnu ravan. U drugoj polovini ciklusa polarizovanost je obrnuta, pa se joni fokusiraju u vertikalnoj ravni. Električno polje kvadrupolnog analizatora nastavlja da se menja na isti način pa nastaje trodimenzionalni talas kretanja jona. Da bi stigli na kolektor, amplituda duž dve ose treba da bude takva, da onemogući privlačenje jona od strane elektrode. Odabirom odgovarajuće radio frekvencije i potencijala, analizator će propuštati jone većeg m/z odnosa do detektora, a joni manjeg m/z odnosa bivaju privučeni ka elektrodama.
Jednosmerni napon, takođe ima uticaja na kretanje jona. Uticaj je veći na „teže“ jone, jer se sporije refokusiraju pod dejstvom radio frekventnog polja, nego „laki“ joni. Zbog toga se oni polako usmeravaju dalje od centra kvadrupola, a pri kraju analizatora privlače ih elektrode [39].
Slika 11. Šema kvadrupolnog analizatora
Snimanje masenog spektra izvodi se promenom jednosmerne i naizmenične komponente napona, pri čemu je njihov odnos konstantan. Kvadrupolni analizator spada u analizatore niske rezolucije [47].
Magnetni analizator ima veću rezoluciju i opseg mase molekula koji mogu da se analiziraju od kvadrupolnog, ali zahteva viši vakuum i često sporije snima spektar. Tipičan opseg rada je do 5000 m/z, ali može ići i do 30 000 m/z. Joni se takođe razdvajaju na bazi m/z odnosa, ali u ovom slučaju primenom magnetnog polja.
U analizatoru sa vremenom preleta (TOF – Tima Of Flight) jonski zrak iz jonskog izvora putuje ka detektoru kroz vakuum gde nema prisustva magnetnog polja. Vreme preleta je funkcija mase jona i dužine putanje, izražava se u μs i može se transformisati u m/z vrednosti. Ovi uređaji imaju visoku osetljivost i sposobnost da brzo skeniraju. Mogu se koristiti za analizu biomolekula velikih masa.
Ion trap analizator skladišti jone za dati eksperiment ili analizu unutar odabranog opsega, m/z odnos je određen naponom, a uređaj zadržava jone u površini oivičenoj elektrodama [7].
.
Detektori masenih spektrometara
Kada se jonske vrste razdvoje u masenom analizatoru potrebno ih je kvalitativno i kantitativno odrediti. Detekcija se najčešće izvodi električnim putem, tako što se meri abundanca – ukupna jonska struja. Kada su abundance male jačine (10-9 – 10-6 A), koriste se razni jednosmerni električni pojačavači (DC – Amplifier), fotomultiplikatori (Photomultiplier konversion dynode), elektron multiplikator (electron multiplier) i dinamički kondezatori (vibrating – reed electrometer) [23].
Princip rada elektron multiplikatora zasniva se na upotrebi više uzastopnih „Faradejevih šolja“, dinoda sa rastućim potencijalom. Jonski zrak iz masenog analizatora pada na elektrodu multiplikatora i izbija elektrone, obično jedan do dva elektrona po jonu. Oni bivaju ubrzani na putu ka sledećoj „Faradejevoj šolji“ koja ima viši potencijal nego predhodna, pa se emituje još veći broj elektrona i tako redom 8 do 20 puta. Na taj način ulazni signal pojačava se do 1012 puta zbog čega ima visoku osetljivost. Najveća osetljivost postiže se pri naponu od oko 3000 V, ali ovako visok napon skraćuje vek trajanja detektora.
Kod fotomultiplikatora joni izlaze iz masenog analizatora, prevode se u fotone i kao takvi detektuju. Ovaj uređaj ima manju osetljivost, ali znatno duži vek trajanja.
.
Vakuum sistem
Maseni spektrometar radi pod visokim vakuumom, pritiska reda veličine 10-2 do 10-7 mbar. Ovakve uslove obezbeđuju dve pumpe: mehanička i difuziona, ili turbomolekularna pumpa. Prva smanjuje pritisak na 10-3 mbar, nakon čega se uključuje druga, osnovna pumpa koja postiže viši vakuum [23].
.
Kalibracija masenog spektrometra
Pre upotrebe maseni spektrometar se mora uravnotežiti. Ovo podrazumeva postizanje stabilne temperature i pritiska, najčešće tokom 24 časa. Sledeća operacija koja predhodi radu je kalibracija. Cilj kalibracije je postizanje optimalnih rezultata tokom analize. U ovom postupku podešavaju se brojni parametri masenog spektrometra, npr. napon ili struja u jonskom izvoru, detektroru i masenom analizatoru, a cilj je podešavanje „masene skale“. Uređaj je najčešće snabdeven programom za automatsku kalibraciju – autotune. Referentna supstanca za kalibraciju kvadrupolnih instrumenata obično je perfluorotributil-amin – PFTBA [23].
.
Primena računara u analizi
S obzirom na veliku količinu podataka i brzinu kojom se oni dobijaju, nemoguće je zamisliti savremenu analizu bez primene računara. Njegova uloga je, osim prikupljanja i obrade podataka, i kontrola rada uređaja. Računar takođe snima spektre, primarno ih obrađuje, prepoznaje i izvodi računanje vezano za primenu MS.
Računaru su osim podataka iz MS potrebni i podaci iz drugih analitičkih postupaka, zatim dokumentacija, kao i komercijalne i sopstvene biblioteke podataka.
.
Tehnike snimanja masenih spektara
Postoje dva načina prikupljanja podataka tokom MS analize:
1) SCAN – podrazumeva snimanje kompletnog masenog spektra
2) SIM (Selected ion monitoring) – prate se samo odabrani joni
SCAN tehnika podrazumeva skeniranje mase u zadatom opsegu uz istovremeno praćenje retencionog vremena. Ovo omogućava identifikaciju analita. Zadati maseni opseg i brzina skeniranja hromatograma određuju vreme praćenja određene mase (dwell time). U toku jednog ciklusa svaka masa iz zadatog opsega se registruje samo jednom, a ciklusi se tokom hromatografisanja ponavljaju. Totalni jonski hromatogram predstavlja grafik zavisnosti ukupnih abundanci sabranih tokom analize, od vremena. Iz njega se dobijaju podaci o kvalitetu (retenciona vremena) i kvantitetu (površina pika), kao i svi hromatogrami dobijeni hromatografisanjem pri konstantnoj dužini. Svaka tačka u TIC predstavlja zbir abundanci svih detektovanih jona. S druge strane, za svaku tačku u memoriji računara postoji ceo maseni spektar dobijen SCAN tehnikom. Na bazi ovih podataka može se prikazati jonski homatogram (IC). Njegovom upotrebom povećava se selektivnost kod pikova koji se preklapaju u velikoj meri, ako su karaktreristični joni preklopljenih komponenti različiti. Skeniranje se najčešće izvodi brzinom od 0,5 do 1 scan/s. SCAN tehnika se više koristi pri kvalitativnoj analizi [23].
SIM tehnika se koristi u kvantitativnim određivanjima. Pre njene upotrebe, da bi se postigli optimalni uslovi, mora se izvesti anliza SCAN metodom. SIM tehnikom detektuju se vrednosti m/z samo reprezentativnih jona posmatranog molekula. Vreme praćenja jona je veće pa se samim tim povećava i osetljivost čak od 100 do 1000 puta. Karakteristični joni, vreme početka snimanja (start time) i vreme praćenja jona (dwell time) odabiraju se na osnovu podataka dobijenih pomoću SCAN tehnike.
Hromatogram se dobija kao zavisnost ukupne abundance sabrane tokom analize od vremena, a daje podatke o kvalitetu (retenciono vreme) i kvantitetu (površina pika) posmatrane komponente. Svaka tačka u hromatogramu predstavlja zbir abundanci posmatranih jona. SIM tehnika se može koristiti i za kvalitativna određivanja komponenata u tragovima.
.
PBM (Probability Based Matching) sistem
PBM sistem identifikuje komponentu poredeći spektre koji se nalaze u postojećoj bazi podataka sa nepoznatim spektrom ispitivane supstance. Za prepoznavanje komponente koristi se postupak vrednovanja na bazi verovatnoće zasnovan na McLafferety-jevom algoritmu. Ovaj sistem primenjuje povratnu metodu pretraživanja, pa se tako celokupni sadržaj biblioteke može uporediti sa nepoznatim spektrom. Pri odabiru najznačajnijih pikova referentnog masenog spektra jednako se vrednuju i masa i abundanca [23].
Reverznim pretraživanjem utvrđuje se da li su pikovi u referentnom masenom spektru prisutni u spektru ispitivane supstance. Ako se u ispitivanom spektru pojavi višak pikova, oni se ignorišu, pa se tako mogu analizirati i maseni spektri smeše analita i prisutnih nečistoća. U većini drugih sistema maseni spektar nepoznatog jedinjenja poredi se sa već poznatim spektrima.
Spisak korišćene literature možete naći u Literatura – Analiza hrane.