Autor: dipl. ing. Dušica Ivanov
Mentor: prof. dr Nikola Marjanović
Masne kiseline su jedinjenja koja ulaze u sastav prirodnih masti i ulja, obično dugih, nerazgranatih lanaca. Mogu biti zasićene, ili nezasićene, a najčešće imaju paran broj ugljenikovih atoma (od četiri do dvadeset šest), što je posledica njihovog nastajanja, odnosno biosinteze masnih kiselina pomoć acetil -CoA. Industrijski se dobijaju hidrolizom estara (triglicerida), poreklom iz masti i bioloških ulja i uklanjanjem glicerola. Trigliceridi sačinjeni od mešovitih masnih kiselina su najrasprostranjeniji, znatno manje ima jednoličnih, dok su mono- i digliceridi vrlo retki [3].
.
Podela i nomenklatura masnih kiselina
Na osnovu prisustva dvostruke veze, masne kiseline se dele na zasićene i nezasićene. U tabeli 1 dat je pregled najzastupljenijih zasićenih masnih kiselina u prirodi.
Tabela 1: Najrasprostranjenije zasićene masne kiseline
| naziv | formula | oznaka |
| buterna | CH3-(CH2)2-COOH | C4:0 |
| kapronska | CH3-(CH2)4-COOH | C6:0 |
| kaprilna | CH3-(CH2)6-COOH | C8:0 |
| kaprinska | CH3-(CH2)8-COOH | C10:0 |
| laurinska | CH3-(CH2)10-COOH | C12:0 |
| miristinska | CH3-(CH2)12-COOH | C14:0 |
| pentadekanska | CH3-(CH2)13-COOH | C15:0 |
| palmitinska | CH3-(CH2)14-COOH | C16:0 |
| margarinska | CH3-(CH2)15-COOH | C17:0 |
| stearinska | CH3-(CH2)16-COOH | C18:0 |
| arahinska | CH3-(CH2)18-COOH | C20:0 |
| behenska | CH3-(CH2)20-COOH | C22:0 |
| lignocerinska | CH3-(CH2)22-COOH | C24:0 |
| cerotinska | CH3-(CH2)24-COOH | C26:0 |
Zasićene masne kiseline ne sadrže dvostruke veze, niti druge funkcionalne grupe duž lanca. Termin zasićene ukazuje na to da ugljenikovi atomi, pored međusobnih, grade veze samo sa vodonikom, (osim u COOH grupi). S obzirom na prave lance koje poseduju, vrlo gusto se pakuju i na taj način omogućavaju živim bićima da na manjem prostoru skladište veliku hemijsku energiju. Upravo zato imaju najveći udeo u masnom tkivu životinja.
Nezasićene masne kiseline su slične građe, ali poseduju jednu, ili više dvostrukih veza u osnovnom ugljeničnom lancu (mono- i polinezasićene). U tabeli 2 dat je pregled najrasprostranjenijih nezasićenih masnih kiselina. Na ugljenikovim atomima koji obrazuju dvostruku vezu, pored vodonika, vezuju se i različite funkcionalne grupe. U zavisnosti od položaja koji vodonikovi atomi pri tome zauzimaju, razlikuju se cis i trans konfiguracija (slika 1).
Tabela 2: Najrasprostranjenije nezasićene masne kiseline
| naziv | formula | oznaka |
| palmitoleinska | CH3-(CH2)5-CH=CH-(CH2)7-COOH | C16:1 |
| oleinska | CH3-(CH2)7-CH=CH-(CH2)7-COOH | C18:1 |
| linolna, ? -6 | CH3-(CH2)4-CH=CH-CH2-CH=CH-(CH2)7-COOH | C18:2 |
| a-linolenska (ALA), ?-3 | CH3-CH2-CH=CH-CH2-CH=CH-CH2-CH=CH-(CH2)4-COOH | C18:3 |
| ?-linolenska (GLA), ?-6 | CH3-(CH2)4-(CH=CH-CH2)2-CH=CH-(CH2)4-COOH | C18:3 |
| 11-eikosenska | CH3-(CH2)7-CH=CH-(CH2)9-COOH | C20:1 |
| arahidonska, ?-6 | CH3-(CH2)4-(CH=CH-CH2)4-(CH2)2-COOH | C20:4 |
| eikosapentaenska (EPA), ?-3 | CH3-CH2-(CH=CH-CH2)5-CH2-CH2-COOH | C20:5 |
| eruka | CH3 -(CH2)7-CH=CH-(CH2)11-COOH | C22:1 |
| dokosaheksaensa (DHA), ?-3 | CH3-CH2-(CH=CH-CH2)6-CH2-COOH | C22:6 |
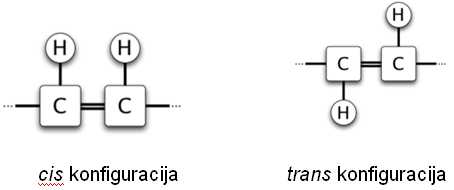
Slika 1. Oblik cis i trans dvostruke veze
Oblik cis veze uslovljava da se molekuli uvijaju. Što je veći broj dvostrukih veza i cis položaja vodonika, to će i uvijenost biti veća, pa će se molekuli nalaziti na međusobno većim rastojanjima. Zbog toga, u uljima dominiraju cis masne kiseline. Nasuprot tome, trans konfiguracija omogućava gusto pakovanje molekula koji su pretežno linearni, ili slabo uvijeni, pa su ove kiseline zastupljenije u čvrstim mastima.
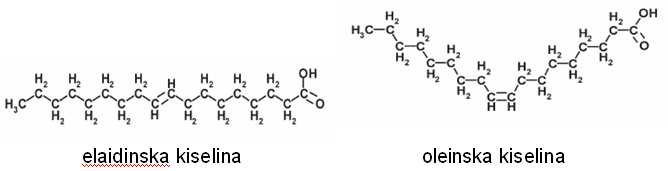
Isti molekuli koji se međusobno razlikuju samo po konfiguraciji dvostruke veze (geometrijski izomeri) mogu imati potpuno različite fizičke i hemijske osobine. Primer za ovo su oleinska i elaidinska kiselina (slika 2), obe sa istom bruto hemijskom formulom C18H34O2. Oleinska kiselina je cis izomer masne kiseline C18:1 i zastupljena je u maslinovom ulju u količini od 55 do 80 %, a elaidinska kiselina je trans izomer i najčešće se nalazi u hidrogenovanim biljnim uljima [4].
Slika 2. Prostorna struktura elaidinske i oleinske kiseline
Elaidinska kiselina ima veću termodinamičku stabilnost i znatno višu temperaturu topljenja (46.5 ºC) od oleinske, čija je temperatura topljenja 13.5 ºC.
Za obeležavanje masnih kiselina najčešće se koristi IUPAC (Union of Pure and Applied Chemistry) nomenklatura. Dužina osnovnog ugljenikovog lanca označava se brojem ispred imena, a položaj dvostrukih veza brojevima iza imena kiseline. Trans konfiguracija označena je slovom t, a cis slovom c. Mesto pojavljivanja trans konfiguracije računato od karboksilnog kraja molekula, obeležava se brojem ispred slova t [5]. Trans veza se označava još i slovom E (nemački: entgegen – nasuprot), a cis slovom Z (nemački: zusammen – zajedno).
Ljudsko telo može da sintetiše sve, osim tri masne kiseline koje su mu neophodne. S obzirom na to, one se nazivaju esencijalnim i moraju se unositi hranom. To su linolna, α-linolenska i arahidonska kiselina. Mogu se naći u velikim količinama u biljkama i ribljem ulju, a u organizmu se prvenstveno koriste za sintezu hormona, koji regulišu krvni pritisak, nivo masti u krvi, utiču na imuni sistem i odbranu organizma od infekcija, sastavni su deo membranskih lipida i prekursori prostaglandina. Ove kiseline poseduju dvostruke veze na ω-3 i ω-6 ugljenikovom atomu. U čovečjem telu ne postoji mehanizam za sintezu upravo tih veza. Njihov nedostatak može izazvati depresiju ili agresiju u ponašanju [4].
Slobodne masne kiseline najčešće nastaju razlaganjem triglicerida, pri čemu se dobija i glicerol. Predstavljaju značajan izvor energije, s obzirom na to da mogu osloboditi relativno veliku količinu ATP-a. Mnogi tipovi ćelija ih koriste u tu svrhu u nedostatku glukoze, a srčani i skeletni mišići ih koriste pre nego glukozu [4].
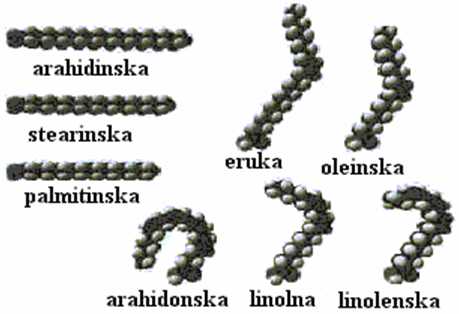
Na slici 3 prikazana je razlika u prostornoj strukturi zasićenih i nezasićenih masnih kiselina.
Slika 3. Prostorna struktura zasićenih i nezasićenih masnih kiselina.
.
Fizičke i hemijske osobine
.
Fizičke osobine
Masti imaju široku primenu u prehrambenoj industriji, a hrani, čiji su sastojak, daju odgovarajuću konzistenciju, topljivost i plastičnost. Pri tome, od njihovog sastava, količine i osobina zavisi tehnološki postupak koji se koristi u proizvodnji namirnica. Zbog toga se proučavanju fizičkih karakteristika masnih kiselina poklanja velika pažnja.
Tačka topljenja masnih kiselina raste sa porastom dužine ugljovodoničnog lanca i stepenom zasićenosti. Obrnuto tome menja im se rastvorljivost. Na temperaturama višim od tačke topljenja, mešaju se sa mnogim organskim rastvaračima: etrima, estrima, ketonima i raznim drugim ugljovodonicima [4].
U vodi su masne kiseline sa dugim ugljovodoničnim lancima gotovo nerastvorne. Za njih je karakteristično obrazovanje micele sa negativno naelektrisanim COOˉ krajem okrenutim ka vodi, a nepolarnim nizom ugljovodonika ka unutrašnjosti. Na taj način micele dobijaju negativno naelektrisanje, međusobno se odbijaju i tako formiraju suspenziju [6].
Viskozitet opada sa povećanjem nezasićenosti molekula, a raste sa povećanjem molekulske mase. Zato su ulja, koja sadrže masne kiseline male molekulske mase, manje viskozna od onih koja sadrže masne kiseline velike molekulske mase.
Indeks prelamanja svetlosti raste sa porastom dužine lanca, broja dvostrukih veza i konjugacije. U praksi se upotrebljava za identifikaciju i određivanje čistoće masti i ulja.
Još jedna bitna karakteristika je dielektrična konstanta, koja takođe raste sa porastom broja dvostrukih veza, a opada sa porastom temperature. Koristi se za kontrolu proizvoda, koji pored masti sadrže i veću količinu vlage, jer ova veličina zavisi od načina formiranja emulzije i odnosa tečne i masne faze u njoj [7, 8].
.
Hemijske osobine
Masne kiseline reaguju isto kao i sve druge ugljovodonične kiseline, što znači da su podložne esterifikaciji i oksido-redukciji. U esterifikaciji se umesto glicerola mogu koristiti i neki drugi jednovalentni ili polivalentni alkoholi. Redukcijom masnih kiselina dobijaju se masni alkoholi [7].
Saponifikacija je jedna od najvažnijih i u industriji najprimenjenijih reakcija, a kao proizvodi se dobijaju alkalne soli ili sapuni.
Oksidaciji masne kiseline podležu i na sobnim temperaturama. Pri tome se razlažu na ketone, aldehide i manje količine epoksida i alkohola. Katalizatori ovih reakcija su teški metali čak i u vrlo malim koncetracijama. Zbog toga se masti i ulja štite dodatkom različitih antioksidanasa, kao što je, na primer, askorbinska kiselina. Na povišenom pritisku i uz metalne katalizatore, masne kiseline reaguju sa vodonikom i prelaze u alifatične alkohole, a tretiranjem amonijakom ili aminima dobijaju se amidi.
Reaktivnost nezasićenih masnih kiselina zavisi od položaja i broja dvostrukih veza. Što su nezasićene veze bliže jedna drugoj, molekuli su reaktivniji. Za ovu grupu kiselina karakteristične je adicija, najčešće hidrogenacija, koja se koristi za prevođenja biljnih ulja u masti. Značajne su još i izomerizacija, polimerizacija, sulfonovanje, sulfatovanje i druge reakcije [3, 7].
Masne kiseline kratkih lanaca disosuju u vodi dajući jako kiselu sredinu. Kiseline dužih lanaca ne pokazuju velike promene u pKa vrednosti. Ipak, povećavanjem dužine lanca naglo se smanjuje rastvorljivost masnih kiselina u vodi, pa je smanjen i njihov uticaj na pH. Značaj njihovih pKa vrednosti je samo u određivanju tipa reakcije u kojoj će kiseline učestvovati [3].
Spisak korišćene literature možete naći u Literatura – Hemija hrane.