.
Autor: Biljana Pešović, dipl. ing.
Mentor: prof. dr Ljiljana Petrović
.
.
Meso je veoma značajna namirnica u ishrani ljudi, jer je izvor lako svarljivih i biološki i energetski vrednih sastojaka. Po sadržaju nutritivnih sastojaka meso se može meriti sa najcenjenijom namirnicom – mlekom (Rede i Petrović, 1997).
Pod pojmom meso u najužem smislu, podrazumeva se skeletna muskulatura sa pripadajućim vezivnim i masnim tkivom, nervnim i krvnim sudovima, a iz koje je odstranjeno koštano, hrskavično, grubo vezivno tkivo, kao i veće naslage spoljašnjeg masnog tkiva (Rede i Petrović, 1997).
Polazeći od prethodne definicije pojma mesa, u užem smislu sledi da hemijski sastav mesa zavisi, pre svega, od odnosa pojedinih tkiva u mišiću u momentu smrti životinje. Taj odnos može veoma varirati, u zavisnosti od brojnih i složenih premortalnih faktora (Rede i Petrović, 1997).
Prema podacima Forresta (1975), skeletni mišići sadrže oko: 75.0% vode, 18.5% proteina, 3.0% lipida, 1.5% neproteinskih azotnih jedinjenja, 1.0% ugljenih hidrata i neazotnih jedinjenja i 1.0% neorganskih materija u odnosu na masu svežeg mišića.
Proteini mesa su visoko vredni, jer sadrže sve esencijalne aminokiseline u optimalnom odnosu, pa ih ljudski organizam može u potpunosti iskoristiti (Rede i Petrović, 1997).
Zavisno od sadržaja masti meso može imati i veliku energetsku vrednost. Masti su, pored proteina, najvažnija hranljiva komponenta mesa. Pored energetske vrednosti, poseduju i biološku vrednost koja se meri količinom esencijalnih masnih kiselina (Rede i Petrović, 1997; Lawrie, 1998).
Meso ne sadrži sve poznate vitamine, ali je zadovoljavajući izvor vitamina A, i bogat izvor vitamina B-grupe, posebno niacina. U mesu se, takođe, nalazi i dosta mineralnih materija i ono se može smatrati vrlo značajnim izvorom gvožđa, Fe (Rede i Petrović, 1997).
Organizmu odraslog čoveka je dnevno potrebno 0.8g proteina na 1kg telesne mase ili u proseku 45 do 55g, što bi se moglo podmiriti sa oko 250 do 300g mesa, međutim, zbog pozitivnog efekta nutritivnih vlakana, poželjno je da 1/3 proteina bude životinjskog,a 2/3 biljnog porekla, a to znači da je dovoljno da čovek dnevno konzumira 100 -150g mesa ( Rede i Petrović,1997).
Za potpunije iskorišćenje proteina, odnosno za potpuno zadovoljenje organizma za svim aminokiselinama obrok treba pripremiti tako da se u jelu nalazi više različitih izvora proteina. Na taj način aminokiseline se dopunjuju, tj. sadržaj aminokiselina u obroku je izbalansiran. Da bi odnos aminokiselina bio povoljan bar polovina proteina u dnevnom obroku treba da je životinjskog porekla (Grujić, 2000).
.
SASTAV I GRAĐA MIŠIĆNOG TKIVA
Organizam životinja za klanje je izgrađen od tkiva različitih po izgledu i po funkciji. Tkiva se mogu podeliti u nekoliko grupa :a) epitelna, b) vezivna, c) potporna, d) mišićna, e) krv i limfa i f) nervno tkivo (Rede i Petrović, 1997).
Tkiva su sastavljena od jedne ili više vrsta ćelijica, međućelijske supstance i vlakana. Umesto međućelijske supstance, u kojoj su smeštene ćelijice, one mogu biti povezane finim opnama rastresitog vezivnog tkiva. U raznim tkivima nalaze se ćelije različitog izgleda, veličine, građe i različite funkcije. Neka tkiva su izgrađena od jedne vrste, dok su druga sastavljena od dve ili više vrsta funkcionalnih ćelijica (Rede i Petrović, 1997).
Mišićna tkiva se dele na poprečno-prugasto ili skeletno, glatko i srčano mišićno tkivo. Poprečno-prugasto tkivo čini skeletnu muskulaturu, srčano je samo u srcu, dok se glatko mišićno tkivo nalazi u zidovima probavnih organa, krvih sudova, mokraćovoda i drugih kanala (Rede i Petrović, 1997).
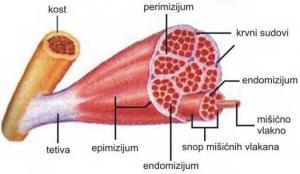
Skeletni mišići su obavijeni vezivno-tkivnom tvorevinom koja se nazva epimizijum. Iz njega polaze elementi vezivnog tkiva koji dele mišić formirajući snopiće vlakana. Taj deo vezivnog tkiva se naziva perimizijum. Snopovi mišićnih vlakana mogu biti različitog stepena organizacije, a označavaju se kao primarni, sekundarni i tercijarni. Vrlo fini produžeci vezivnog tkiva obavijaju svako mišićno vlakno i naslanjaju se na pravu ćelijsku membranu. Taj tanak vezivni omotač se naziva endomizijum. Takva građa mišića obezbeđuje njegovu kompaktnost i omogućuje prolaz krvnih sudova i živaca. Krvni sudovi ulaze u mišiće kroz epimizijum, granaju se u premizijumu i kao kapilari ulaze u endomizijum (Rede i Petrović, 1997).
SLIKA 2.1. Šematski prikaz građe skeletnog mišića
Poprečno-prugasto ili skeletno mišićno tkivo je najvažnije sa stanovišta tehnologije mesa. Ono se sastoji od jako izduženih vlakana. To su mnogojedarne ćelijice, dužine najčešće od 1 do 5cm, a mogu biti i do 30cm duge. Promer im je od 10 do 100µm, ređe 150µm (Rede i Petrović, 1997).
Mišićno vlakno se sastoji od opne (sarkoleme), a ispunjeno je sarkoplazmom, u kojoj su smeštena jedra, miofibrili i druge organele i inkluzije (Rahelić, 1978).
Sarkolema je fina ovojnica koja obavija čitavo vlakno, a sastoji se od dva sloja, ukupne debljine oko 10nm. Na spoljni sloj sarkoplazme se vezuje medjućelijsko vezivno tkivo (endomizijum). Sarkolema je mehanički otporniji deo mišićnog vlakna (Rede i Petrović, 1997).
Sarkoplazma je citoplazma mišićnog vlakna. U njoj su smešteni svi ostali sastojci vlakna. Količina sarkoplazme jako varira u raznim tipovima mišićnih vlakana. U mišićnim vlaknima sa više sarkoplazme ima i više mitohondrija, kapljica masti i granula glikogena, kao i mioglobina, pa su ona crvene boje.Takvih vlakana ima više u mišićima koji napornije rade (Rede i Petrović, 1997).
Jedra se u mišinim vlaknima nalaze periferno, uz sarkolemu. Ona su duguljastog oblika i položena u smeru duže osovine vlakna, a dužina im je 8-10µm. U svakom vlaknu ima par stotina jedara u kojima se nalaze hromozomi, sastavljeni od gena, a ovi od DNA i belančevina. Pored toga što se u jedrima sintetizuju DNA, RNA i belančevine, u njima se nalaze i enzimi sinteze koenzima NAD i NADP (Rede i Petrović, 1997).
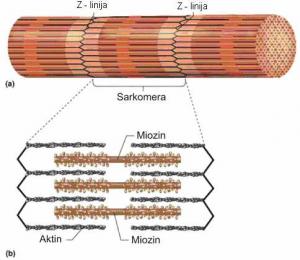
Funkcionalne organele mišićnih vlakana nazivaju se miofibrili. Položeni su pojedinačno ili u snopovima, paralelno sa osovinom vlakna. Promer im je 1-2 µm, a u jednom vlaknu ih može biti i do 2000. Miofibrili su izgrađeni od vlakanaca (miofilamenata), raspoređenih u dva susedna segmenta. Debeli (miozinski) filamenti se nalaze u tamnom, anizotropnom ili A-segmentu, a tanki (aktinski) filamenti se pružaju duž svetlog, izotropnog ili I-segmenta i ulaze u tamni, A-segment između debelih miofilamenata. Pored toga što različito prelamaju svetlost, ovi segmenti se naizmenično smenjuju, a u svim miofibrilima su u istoj visini, te se mišićno vlakno pod mikroskopom vidi kao poprečno prugasto (Rede i Petrović, 1997).
Svako svetlo polje podeljeno je jednom tamnom Z-linijom na dva dela. Rastojanje između dve Z-linije naziva se sarkomera, koja predstavlja strukturnu i funkcionalnu jedinicu miofibrila (Vuković, 1998). Predpostavlja se da u građi Z-linije, ondosvo Z-membrane učestvuje niz belančevina. Pri tome većina autora smatra da su aktin i α-aktinin odgovorni za strukturu Z-membrane. U novije vreme spominju se još dve belančevine koje se nalaze periferno u Z-membrani : vinkulin i filamin. Za belančevinu desmin, u nekim radovima spominje se još i belančevina vimentin, kaže se da učestvuju u povezivanju Z-membrana susednih miofibrila. Pretpostavlja se da je uloga desmina da spaja miofibrile i da na taj način održava ukupni integritet ćelija skeletnih mišića (Rede i Petrović, 1997).
SLIKA 2.2. Šematski prikaz građe miofibrila (a) i debelih i tankih miofilamenata (b)
U sredini A-segmenta nalazi se H-pruga (tj. Hanzenova pruga), svetlija od svoje okoline, u kojoj se nalaze samo debeli miofilamenti. Kroz centar H-pruge prolazi tamna M-linija, tj. jedna rešetka koja održava karakterističan položaj miofilamenata u prostoru. Dužina sarkomere i širina H-pruge su promenljive i zavise od stanja mišićne kontrakcije (Vuković, 1998).
Mitohondrije su u mišićnom vlaknu smeštene u blizini jedara i oko miofibrila u visini Z – membrane (Rede i Petrović, 1997).
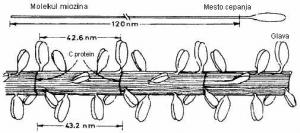
Osnovni protein debelog miofilamenta je miozin. Miozina ima najviše u odnosu na druge proteine u mišiću (oko 30%), kao i u odnosu na maofibrilarne (oko 50-55%). Debeli ili miozinski miofilamenti se sastoje od nekoliko stotina molekula miozina koji se spajaju po tačno utvrđenom redu. Molekule miozina su fibrilarni proteini, na kojima se razlikuje duži štapićasti deo (rep ili laki meromiozon – LMM), kraći zadebljali deo (glava ili teški meromiozon – HMM) i vrat molekula između njih (Briskey i Fukazawa, 1971; Rahelić, 1978). Pri formiranju debelog miofilamenta molekule miozina su položene uzdužno jedna pored druge i to tako da se u sredini filamenta spajaju repovi molekula koji se dalje slažu u suprotnim pravcima i tako formiraju filament (Rede i Petrović, 1997).
Pored miozina u građi debelih miofilamenata učestvuju i neki drugi proteini, kao što su: C-protein, koji u obliku obruča obavija i spaja molekule miozina, M-proteini, koji su smešteni u M-pruzi i omogućavaju povezivanje krajeva molekula miozina u kompletnu celinu (Cassens, 1986).
SLIKA 2.3. Šematski prikaz strukture molekula miozina (Bendall, 1970) i građe debelog miofilamenta (Hamm, 1972)
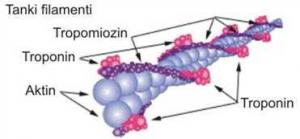
Tanki miofilamenti su građeni od 300-400 molekula G-aktina i po 40-60 molekula tropomiozina i troponina. Osim ovih, u građi tankih miofilamenata učestvuju i drugi proteini : α i β– aktinin, vinkulin i filamin. Aktin je drugi „kontraktilni“ protein miopfibrila. To je ujedno i protein koji je posle miozina najviše prisutan u mišićnom tkivu i to u količini od 11 do 17%. Molekule tropomiozina su fibrilarne građe (jedna molekula prekriva sedam molekula G-aktina) i međusobno su povezane u dugačku nit, a dve niti grade dupli heliks. Troponin je proteinski kompleks sastavljen od tri globularne subjedinice: troponina C (TnC); troponina I (TnI); i troponina T (TnT), koji vezuje (TnC) i (TnI) za tropomiozin, a time i za tanki filament. α i β-aktinin deluju kao osnova oko koje se formira aktinski miofilament, pri čemu određuju i njegovu dužinu (Rede i Petrović, 1997).
SLIKA 2.4. Šematski prikaz građe tankog filamenta
U novije vreme elekronskom mikroskopijom je utvrđeno postojanje i treće grupe filamenata, pored debelih i tankih, unutar sarkomere, ali njihova uloga nije još u potpunosti razjašnjena. Neki autori (Loocker i Leet, 1976) su označili ove filamente kao gap filamente ili „međuprostorne“ filamente koji imaju vezu sa strukturnim integritetom sarkomere, a povezani su i sa tankim i sa debelim miofilamentima. Gap filamenti su građeni od dve belančevine : titina (konektina) i nebulina. Ove belančevine se ponekad označavaju i kao miorfibrilarno / citoskeletne, pošto se veruje da one predstavljaju strukturni oslonac sarkomere, a ne i drugih kontraktilnih elemenata. Smatra se da titin pomaže održavanju miozinskih filamenata u A-segmentu, on ne učestvuje u kontrakciji, ali svojom elastičnošću prati sarkomere i pomaže održavanje longitudinalne strukture miofilamenata unutar sarkomere, a lociran je uizmeđu debelih i tankih miofilamenata. Nebulin je lokalizovan u I-segmentu na N2 liniji, a ima ulogu u organizaciji trodimenzionalne mreže tankih filamenata I-zone (Rede i Petrović, 1997; Lawrie, 1998).
.
SASTAV I GRAĐA VEZIVNOTKIVNIH PROTEINA
Vezivno tkivo je matriks, osnova ili potpora svih organa. Spaja delove organa u organizmu, dajući mu određen oblik i čvrstinu. Vezivno tkivo prekriva sve elemente mišića (endomisijum, perimisijum, epimisijum), te predstavlja u određenom smislu, njegov neodvojivi deo (Rede i Petrović, 1997).
Vezivna tkiva se dele na retikularno, rastresito, kolageno i elastično. Retikularno vezivno tkivo čini mrežastu osnovu nekih organa (slezina, limfni čvorovi), rastresito je razvijeno oko onih ograna koji zahtevaju delimičnu pokretljivost, a to su mišići i krvni sudovi. Kolageno tkivo gradi tetive, aponeuroze i fascije, a elastično je u ligamentima, u zidu krvnih sudova i plućnih alveola. U vezivnim tkivima su ćelijice odvojene amorfnom međućelijskom supstancom (Rede i Petrović, 1997).
Vezivnotkivni proteini čine oko 15% ukupnih proteina mesa u najužem smislu. Dva osnovna vezivnotkivna proteina, kolagen i elastin, zastupljeni su u mišiću sa oko 1,5% ili u ukupnim proteinima mišićnog tkiva sa 8-10% (Rede i Petrović, 1997).
U rastresitom i kolagenom vezivnom tkivu dominiraju kolagena vlakna izgrađena od proteina kolagen, a u elastičnom tkivu elastična vlakna izgrađena od proteina elastin (Rede i Petrović, 1997).
Vezivno tkivo grade ćelije, osnovna supstancija i vanćelijska vlakna. Ćelije vezivnog tkiva (fibroblasti i fibrociti) luče osnovnu supstanciju, koju čine rastvoreni glikoproteidi (hijaluronska kiselina, hondrotoin-sulfati), tropokolagen i tropoelastin, iz kojih se u osnovnoj supstanciji obrazuju kolagen i elastična vlakna (Vuković, 1998).
Kolagen je gotvo najrasprostranjeniji protein u organizmu životinja (čini oko 25% ukupnih proteina ogranizma i više od 1/3 ukupnih proteina mesa), jer izgrađuje kolagena vlakna koja su ugrađena kao potporno tkivo u sve organe organizma.Pored strukturne uloge u zrelim tkivima, kolagen direktno učestvuje i u razvoju tkiva (Rede i Petrović, 1997).
Osnovna karakteristrika kologena je da formira nerastvorljiva vlakna sa vrlo dobrim mehaničkim svojstvima. Kolagen je odlučujući faktor teksture kuvanog mesa. Sam kvalitet kolagena je manje bitan od njegovog kvantiteta (Varnam i Sutherland, 1995)..
Treba posebno istaći da količina kolagena nije primarni faktor koji utiče na čvrstoću, odnosno nežnost mesa, nego je to broj i vrsta poprečnih veza u kolagenu. Prema tome, meso starijih životinja nije tvrdo zbog toga što sadrži više vezivnog tkiva, nego zbog promena u srukturi tog tkiva. Time se objašnjavaju i razlike u nežnosti razkičitih mišića iste životinje (Rede i Petrović, 1997).
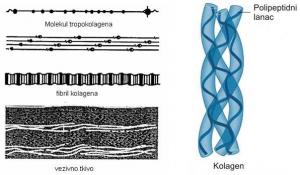
Kolagena vlakna nastaju povezivanjem molekula tropokolagena, koji grade najpre mikrofibrile, zatim fibrile i, najzad, vlakna (Vuković, 1998).
Tropokolagen je osnovna molekulska jedinica kolagena, ima oblik štapića dužine oko 300nm i dijametra 1.5nm,to je najduži poznat protein, molekulske mase je oko 300.000. Molekul tropokolagena je sastavljen od tri polipeptidna lanca. Svaki lanac je pojedinačno uvrnut u α-heličnu konformaciju, a sva tri zajedno čine trostruki heliks ili „super“ heliks, odnosno molekule tropokolagena koje se dalje međusobno povezuju gradeći kolagen i kolagena vlakna (Rede i Petrović, 1997).
Osnovni α-polipeptidni lanac ima dosta jednostavnu ponavljajuću primarnu strukturu Gly-X-Y, gde je X često prolin, a Y hidroksiprolin. Lanac je desnosmerni i po dužini ima oko 1000 rezidua sa po tri aminokiseline po okretu. Pored ovih aminokiselina, na tim pozicijama se mogu naći i druge aminokiseline i to glutamin, leucin i fenilalanin dominantno na poziciji X, a treonin, lizin i arginin na poziciji Y (Bailey i Light, 1989).
Pojedinačni α-polipeptidni lanci se međusobno povezuju intramolekularno, preko vodoničnih mostova, gradeći trostruki heliks tropokolagena (Rede i Petrović, 1997).
Hidrogenske veze između pojedinačnih polipeptidnih lanaca u kojima učestvuju rezidue prolina i hidroksiprolina uspostavljaju se preko molekula vode (Bailey i Light, 1989).
Voda je, u stvari, važna komponenta nativnog kologena. Ako se zagreva rastvor tropokolagena, viskozitet naglo opada ukazujući da su molekuli izgubili oblik niti, tj. da je uništena helična struktura (Rede i Petrović, 2002).
Prema načinu vezivanja molekula tropokolagena razlikuju se tri familije, tj. grupe kolagena: a) fibrilarni ili vlaknasti (I, II, III, V, IX), koji su najrasprosranjeniji, b) nefibrilarni (IV), ugrađeni u bazalne membrane i c) filamentozni ili končasti (VI, VII), koji je prisutan u malim količinama, ali je značajan u određenim tkivima (Bailey i Light, 1989; Rede i Petrović, 1997).
SLIKA 2.5. Građa fibrilarnog kolagena
U skeletnim mišićima nalazi se pretežno fibrilarni kolagen, u kojem molekuli tropokolagena preklapaju susedne molekule jednom četvrtinom svoje dužine. Epimizijum i perimizijum grade tipovi I i III, a endomizijum fibrilarni tipovi III i V i filamentozni tip Vll kolagena. Veze između molekula tropokolagena pri formiranju fibrila kolagena nastaju oksidativnom dezaminacijom terminalnih ostataka lizina (Bailey i Light, 1989). Protein elastin je osnovna komponenta elastičnih vlakana, koja mogu biti vrlo varijabilne strukture. U endomizijumu su kratka i nežna, a u perimizijumu duga. Granaju se i spajajući se međusobno formiraju rastresitu mrežu. U ligamentima su paralelno položena u pravcu ose ligamenta, u krvnim sudovima se nalaze u vidu kružne membrane različite debljine, a u elastičnim hrskavicama su vezana slično mreži. Vlakna su svetlije boje i mnogo tanja od kolagenih vlakana (Rede i Petrović, 1997). Karakteristika im je da su elastična, sposobna su da se istegnu dve svoje dužine a da pri tome zadrže elastičnost, odnosno da se ponovo skupe do svoje prvobitne dužine. Otporna su na delovanje toplote i do 150ºC (Rede i Petrović, 1997).
Elastična vlakna se veoma razlikuju od kolagenih. Strukturno ih čine dva različita proteinska komleksa. U zrelom elastičnom vlaknu glavna komponenta je elastin amorfne strukture, a na periferiji se nalaze miofibrili dijametra 10-12 nm. Elastin je visoko hidrofilni protein koji formira izrazito nerastvorljivu matricu vlakana sa osobinama elastina. Elastin sadrži oko 55% vode, od kojih se 40% može lako ukloniti tako da proizvod ostane krt. Voda je, dakle, neophodna da bi protein imao osobine elastomera (Rede i Petrović, 1997).
Monomer elastina, tropoelastin ima molekulsku masu od 74.000. U aminokiselinskom sastavu elastina nalazi se oko 40% glicina prolina i oko 40% hidrofobnih aminokiselina. Ispitivanja pokayuju da je molekul građen od dva segmenta, prvi sa 20 aminokiselinskih rezidua, a drugi sa 4. Lanac budućeg dužeg peptida ima hidrofobnu sekvencu koja se ponavlja Pro-Gly-Val-Gly-Val i koja je odgovorna za buduću tercijarnu srukturu. Manja pepidna sekvenca sadrži dosta alanina i odgovorna je za poprečno povezivanje. Sekvenca Ala-Ala-Lyz se ponavlja nekoliko puta, a interesantno je da tropoelastin sadrži ponavljajuću sekvencu od 17 Gly-X-Y tripleta. Ali, nađeno je da je prolin generalno na Y poziciji češće nego na X, gde se nalazi u kolagenu. Zbog toga trostruka helična konformacija elastina nije moguća (Rede i Petrović, 1997).
Tropoelastin sadrži, takođe i malo hidroksiprolina (1.5%), ali mu uloga i funkcija nisu poznati, nema hidroksilizina i više polarnih aminokiselina, ali je vrlo bogat nepolarnim alifatičnim reziduama kao što su alanin , leucin i izoleucin (Rede i Petrović, 1997).
Poprečnim povezivanjem molekula tropoelastina procesom koacervacije stvaraju se elastična vlakna. Za poprečno povezivanje tropoelastina i nastanak elastina, kao i kod kolagena, fundamentalno je stvaranje „Šifovih“ baza između dezaminiranih grupa lizina koje grade aldehide i amino grupa susednih aminokiselina (Rede i Petrović, 1997).
.
MASNO TKIVO
Masno tkivo je sastavljeno od krupnih okruglastih ćelijica – steatocita. Te ćelijice se razvijaju u velikom broju na određenim mestima u organizmu gde ima rastresitog vezivnog tkiva, kada organizam unosi više enrgije nego što je troši. Grupe masnih ćelijica su obavijene vezivnim tkivom kroz koje prolaze krvni sudovi. Masno tkivo se najčešće razvija u podkožju, oko bubrega, ispod potrbušnice i u mezenterijumu, kao i oko zglobova i krvih sudova (Rede i Petrović, 1997).
Lipida posle vode i proteina ima najviše u mišiću, a ujedno to je i najpromenljivija komponenta u sastavu mišića odnosno mesa u užem smislu, a posebno mesa u širem smislu. Naime, lipidi se u mesu nalaze intramuskularno i eksramuskularno (Rede i Petrović, 1997).
Lipidi su pored proteina najvažnija hranljiva komponenta mesa. Uloga lipida kao osnovne energetske materije u ishrani dobro je poznata (Rede i Petrović, 1997).
Konzistencija masti bitno zavisi od zasićenosti masnih kiselina. Masti su utoliko mekše, ili tečljivije, ukoliko je u njima veća količina nezasićenih masnih kiselina. U goveđem ili ovčijem loju ima mnogo zasićenih masnih kiselina, goveđi i ovčiji loj su, stoga, veoma čvrsti. Svinjska mast sadrži više nezasićenih masnih kiselina, pa joj je konzistencija mekša. Mekša konzistencija svinjske masti je u osnovi uslovljena velikim sadržajem oleinske kiseline (Rede i Petrović, 1997).
Čvrstina životinjskih masnih tkiva nije određena samo konzistencijom masti, nego zavisi i od čvrstine tkiva koja okružuju masno tkivo (slanina i salo) (Rede i Petrović, 1997).
Svinjsko meso zbog većeg sadržaja polinezasićenih masnih kiselina u odnosu na goveđe ili ovčije meso ima veću biološku vrednost (Rede i Petrović, 1997).
Masno tkivo zaklanih životinja sadrži 50 do 90% masti, 3 do 35% vode, 2 do 15% proteina i 0.1 do 0.6% mineralnih materija (Lawrie, 1998).
Masti masnog tkiva su po sastavu najvećim delom trigliceridi i nalaze se u ćelijama, dok su voda, proteini i mineralne materije sastojci vezivnotkivne strome. Sadržaj masti u masnom tkivu je vrlo promenjiv i zavisi naročito od uhranjenosti, starosti i vrste životinje, kao i načina gajenja, a znatne razlike u sadržaju masti postoje u različitim regijama masnog tkiva na trupu životinje. Vuković (1998) navodi da trbušna (mesnata) slanina svinja sadrži 50 do 60% masti, masno tkivo vrata i grebena (čvrsto masno tkivo – ČMT) 84 do 89%, obrazine (gronik) 59 do 74%, leđno masno tkivo (ČMT) 87 do 91%, masno tkivo butova (meko masno tkivo – MMT) 83 do 90% i bubrežno masno tkivo (salo) 90 do 95%.
Zurović (2005) je proučavao osnovni hemijski sastav masnih odrezaka, nativnih kožica, čvrstog masnog tkiva (ČMT) i mekog masnog tkiva (MMT) dobijenih rasecanjem svinjskih polutki za maloprodaju i veleprodaju. Analizom ovih anatomskih delova utvrđeno je da oni sadrže : od 10,51 do 52,05% vode, 0,11 do 0.70% pepela, od 3,32 do 23,90% proteina i 32,67 do 85,01% masti (Tabela 1.1). Iz prikazanih rezultata se vidi da nativne kožice i masni odresci sadrže znatno više proteina nego ČMT i MMT, dok je relativni sastav proteina vezivnog tkiva u ukupnim proteinima najveći kod nativnih kožica, a najmanji kod masnih odrezaka. Takođe se može zaključiti da je sadržaj masti znatno veći kod ČMT i MMT (85,01, ondosno 80,57%), nego kod masnih odrezaka i nativnih kožica u kojima iznosi 32,67, odnosno 33,25%.
Tabela 1.1. Prosečni rezultati određivanja sadržaja vode, pepela, proteina, masti i RSPVT u tkivima dobijenim rasecanjem svinjskih polutki za veleprodaju i maloprodaju
| Sadržaj vode (%) | Sadržaj pepela (%) | Sadržaj proteina (%) | Sadržaj masti (%) | RSPVT (%) | Ukupno (%) | |
| Masni odresci | 52.05 | 0.70 | 13.55 | 32.67 | 11.66 | 98.97 |
| Nativne kožice | 42.03 | 0.26 | 23.90 | 33.25 | 55.66 | 99.44 |
| ČMT | 10.51 | 0.11 | 3.32 | 85.01 | 39.70 | 98.95 |
| MMT | 14.80 | 0.11 | 4.00 | 80.57 | 46.66 | 99.48 |
.
SPOSOBNOST MESA DA VEŽE VODU
Svojstvo mesa da vlastitu vodu, kao i vodu dodatu pod određenim uslovima, zadrži u većoj ili manjoj meri i pri primeni neke spoljne sile, na primer, pritiska ili zagrevanja, označava se kao sposobnost vezivanja vode (SVV) ili sposobnost zadržavanja vode (Rede i Petrović, 1997).
To svojstvo mesa treba razlikovati od svojstva bubrenja, pod kojim se podrazumeva spontano upijanje vode iz okolne tečnosti uz povećanje mase i volumena (Rede i Petrović, 1997).
Glavni nosilac vezivanja vode u mišiću su miofibrilarni proteini, svakako zbog svoje specifične hemijske građe. Oko 50% maksimalne vrednosti SVV uslovljeno je samo ovim proteinama, a sa još 47% doprinose, takođe fibrilarni proteini, ali pod delovanjem mineralnih materija iz sarkoplazme (Rede, 1974).
Na značaj miofibrilarnih proteina za SVV ukazuje i činjenica da se 70% ukupne vode mišića nalazi unutar miofibrila, samo 20% u sarkoplazmi, a preostalih 10% zadržavaju vezivnotkivne ovojnice (Hamm,1972).
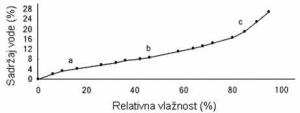
U zavisnosti od udaljenosti molekula vode od proteina mišića i od svojstava proteina, voda je u mesu vezana i slobodna, i to: vezana čvrsto i labavo, a slobodna zadržana imobilizacijom i potpuno slobodna, što se može konstatovati na osnovu adsorpcione izoterme liofilizovanog mišića goveda (Rede i Petrović, 1997).
GRAFIKON 2.1. Adsorpciona izoterma liofilizovanog, usitnjenog goveđeg mesa
Čvrsto vezane vode (odsečak a) u mišićima ima oko 8-10% u odnosu na ukupnu količinu vode (70-75% na masu mišića), pri čemu je, oko 4% ukupne količine vode veoma čvrsto vezano, jer se izdvaja samo pri veoma niskim naponima pare. Količina tako vezane vode odgovara Langmuirovom zakonu, a radi se o monomolekularnoj adsorpciji. Ta količana vode predstavlja samo 1/5 one količine vode koja bi bila potrebna da se molekuli proteina potpuno oblože jednim slojem molekula vode. To ukazuje da je ova voda vezana samo na određene grupe na lancima proteina. Pri većem naponu pare vezuje se sledeća količina vode koja je približno jednaka prethodnoj, tj. čini daljih 4-6% ukupne vode. Verovatno je da molekuli vode grade drugi sloj oko istih grupa na proteinima multimolekularnom adsorpcijom (Rede i Petrović, 1997).
Čvrsto vezana voda za proteine u mono- i multimolekularnom sloju označava se još i kao prava hidrataciona voda. Ova voda je vezana za hidrofilne – polarne grupe proteina, a one mogu biti disocirane ili nedisocirane, ili koje ne disociraju, kao na primer, karbonilne i imido grupe u peptidnim vezama. Ta voda ima manju sposobnost rastvaranja, nižu tačku smrzavanja, ona se znatno teže prevodi u led pri smrzavanju mesa i otpušta pri kuvanju, pa time bitno utiče na svojstva mesa (Rede i Petrović, 1997).
Labavo vezane vode u mišiću ima oko 10% (odsečak b na krivoj). Ta voda je zadržana uz proteine mišića u vidu „rešetkaste strukture“ čije nastajanje indukuju nepolarne grupe proteina mišića (Rede i Petrović, 1997).
lmobilizirana i potpuno slobodna voda čini ostatak od oko 80% vode u mesu. Ta voda leži manje-više slobodno smeštena u spletu filamenata i membrana strukturnih (vezivnotkivnih) proteina, a delimično je verovatno imobilizirana i elektrostatskim silama i poprečnim vezama između lanaca proteina. Imobilizirana voda ima svojstva kao i obična voda, mada jedan deo te vode ima manju sposobnost rastvaranja, kao i delimično ograničenu pokretljivost molekula (odsečak c). Između labavo vezane vode i imobalizirane vode ne može se povući oštra granica, kao što i imobilizirana voda može imati potpunu ili nešto manju slobodu kretanja, te je pod određenim uslovima moguć prelaz iz jednog stanja vode u drugo (Rede i Petrović, 1997).
Sposobnost vezivanja vode nije ni u kakvom odnosu sa apsolutnom količinom vode u mesu, već zavisi od načina vezivanja vode za molekule proteina i od njene imobilizacije unutar mikrostrukture mesa (Živković, 1986).
.
Uticaj nekih faktora na SVV i bubrenje
a) Uticaj vremena post mortem
SVV mesa je najveća neposredno posle klanja, a zatim opada i dostiže minimum u punom rigoru mortis. Nakon toga se povećava, ali ne dostiže prvobitnu vrednost (Honikel, 1986; Rede i Petrović, 1997).
Usled biohemijskih reakcija post mortem ili delovanja spoljnih sila u toku prerade može doći do promene SVV mesa. Ovo svojstvo mesa se menja kroz sve tehnološke faze kroz koje prolazi meso u procesu proizvodnje i prerade: hlađenje, smrzavanje, salamurenje, skladištenje, termička obrada, transport (Oluški, 1973). Za razliku od toga do bubrenja dolazi u nekim postupcima prerade (salamurenja), pri “hidriranju“ mesa (Rede i Petrović, 1997).
Neposredno post mortem, u fazi pre rigora mortisa sarkomera je najduža, miofilamenti se najmanje preklapaju i prostori među njima su najveći, te postoji mogućnost da se u mišiću zadrži najviše vode. U tim uslovima u sarkomeri je imobilizovana najveća količina vode. Prelaskom mišića u rigor mortis krajevi miozinskih filamenata se približavaju Z-membrani i prostori među njima se smanjuju. Posledica toga je da mišić otpušta deo imobilizovane vode. Ove promene u sarkomeri uslovljene su degradacijom ATP-a pri čemu se oslobađa određena količina dvovalentnih katjona, koji utiču na strukturu proteina povećavajući broj veza među lancima. Proteini se više umrežavaju, smanjuju se međuprostori za imobilizaciju vode, te ova biva otpuštena. Istovremeno se smanjuje i neto naboj postranih grupa u lancima proteina, čime je uslovljeno još veće otpuštanje vode (Rede, 1974; Rahelić, 1978).
Uzevši u obzir veliku količinu vode koju meso može da otpusti, odnosno da primi pod određenim okolnostima i male količine prave hidratacione vode (čvrsto i labavo vezane), mora se predpostaviti da se promene SVV tokom uskladištenja (proizvodnje mesa) ili prerade odnose u prvom redu na slobodnu vodu (Rede i Petrović, 1997).
Kada se ima u vidu da je opadanje SVV mišića post mortem uslovljeno padom pH i razgradnjom ATP, a da pad pH, kao i razgradnja ATP-a, naročito u mišičima svinja, vrlo variraju, jasno je da će i pad SVV u mišićima tih životinja varirati (Rede i Petrović, 1997).
b) Uticaj vrednosti pH
pH vrednost mesa direktno utiče na rastvorljivost proteina, a time i na količinu vezane vode. Snižavanjem vrednosti pH i njenim približavanjem IET tokom postmortalnih procesa, raste i denaturacija mišićnih proteina što snižava i „funkcionalnost mesa“. To znači da meso sa vrednostima pH > 6 ima bolju „funkcionalnost“ nego ono sa nižim pH (Degussa Texturant Systems, 2001).
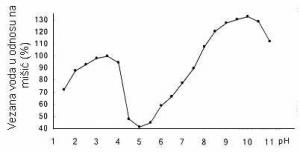
Da je SVV mesa najmanja u IET, tj. kada je pH nešto iznad 5.0, utvrđeno je laboratorijskim ispitivanjima još pre više desetina godina. IET aktomiozina koji nastaje u punom rigoru takođe je nešto iznad 5.0, a glikoliza se zaustavlja pri pH 5.3 ili nešto višem, što je ujedno i pHk mišića. Dakle, u toj fazi proizvodnje mesa mišićni proteini su najviše umreženi brojnim poprečnim vezama. Promenom pH prema kiselom ili baznom području dalje od IET, SVV se povećava. Povećanje SVV zavisno o odstupanju pH od IET, utvrdio je Hamm u svojim pionirskim istraživanjima (1972), u homogenatu goveđeg mišića (Rede i Petrović, 1997).
GRAFIKON 2.2. Uticaj pH na hidrataciju homogenizovanog goveđeg mišića (Hamm,1972)
Iz tih se rezultata vidi da je SVV u baznom području najveća pri pH oko 10, a u kiselom pri pH između 3 i 4. Tu pojavu Hamm objašnjava time da se u kiseloj ili baznoj sredini, dalje od IET razgađuju poprečne veze između lanaca proteina, pri čemu se ti lanci udaljavaju jedni od drugih stvarajući tako veće međuprostore u koje se može uklopiti veća količina vode. Promena SVV izazvana promenom prostorne strukture nazvana je “stereo efektom“, mada se pri kiselom i alkalnom bubrenju, kada se pH udaljava od IET, verovatno radi o zajedničkom delovanju tri efekta: kidanju sonih veza, odbijanju istoimeno naelektrisanih grupa i osmotskom delovanju malih jona, prodrlih u unutrašnjost filamenata (Rede i Petrović, 1997).
c) Uticaj ATP-a
Uticaj ATP na vezivanje vode u mišiću izraženiji je od uticaja pH. Hamm (1972) navodi da uticaj pH i ATP na SVV stoje u odnosu 1:2, tj. da je uticaj ATP dva puta veći od uticaja pH (Rede i Petrović, 1997).
Kada se iz sarkoplazmatičnog retikuluma odpusti nešto Ca2+, s jedne strane i snizi koncentracija ATP, s druge strane, dalazi do aktiviranja miofibrilarne ATPaze i počinje razgradnja ATP-a (kasnije p.m.). posledica toga je odpuštanje zemnoalkalnih katjona pored Ca2+, to su i Mg2+ i Zn2+, koji se sada vezuju na akivne grupe lanaca proteina i približavaju ih stvaranjem mostova. Na taj način struktura proteina se zgušnjava, pri čemu se istiskuje voda, odnosno smanjuje SVV (Rede i Petrović, 1997).
d) Uticaj drugih faktora
Meso soljeno pre rigora mortisa čvršće veže vodu, pa je pad SVV post mortem manji (Hamm i Rede, 1972; Hamm, 1973; Honikel, 1986).
U toku prerade, radi povećanja SVV mesa ono se podvrgava delovanju određenih faktora. Kombinacijom usitnjavanja i dodatkom NaCI i polifosfata deluje se na pH i strukturu proteina, što ima za posledicu povećanje SVV mesa. Takođe, i termička obrada utiče na SVV mesa. Utvrđeno je da su promene izražene većim otpuštanjem vode ako se povisi temperatura ili produži delovanje toplote (Rahelić, 1978). Temperature više od 30°C izazivaju denaturaciju proteina i smanjuju SVV (Honikel, 1986).
Koncentracija kuhinjske soli određuje max. temperaturu do koje se proizvod sme zagrevati, a da ne nastupi signifikantan pad SVV.
Od SVV mesa zavise, s jedne strane, senzorna svojstva, pre svega sočnost, a manje nežnost, boja i ukus, a s druge strane tehnološka svojstva, odnosno podesnost mesa za ođređeni vid prerade.
.
EMULGUJUĆA I DRUGA FUNKCIONALNA SVOJSTVA PROTEINA MIŠIĆA
Emulzija je prisna mešavina dve nemešljive tečnosti, gde je jedna od njih (disperzna faza) rasuta u drugoj (kontiuanualna faza) u formi finih kapljica. Mesne emulzije su normalne emulzije ulja u vodi, gde je voda kontinualna faza. Kada dve nemešljive tečnosti dospeju u kontakt javlja se međufazni napon u međufazi, tj. dve tečnosti žele da se odvoje jedna od druge. U emulzijama što je veći prostor koji zauzima međufaza veći je i međufazni napon. To znači da je potrebno uneti energiju u sistem da bi se formirala emulzija. Što je veći međufazni napon, više je enegrije potrebno da bi se postiglo emulgovanje i veća je težnja faza emulzije da prevedu sistem u prvobitno stanje, tj. kapljice ulja se spajaju u veće i odvajaju od vode. Emulgujući agensi su supstance koje smanjuju međufazni napon i olakšavaju formiranje emulzija. Zbog sopstvene strukture one imaju afinitet i prema ulju i prema vodi. Proteini mesa su prirodni emulgujući agensi, zahvaljujući prirodi aminokiselinskih krajeva od kojih su jedni liofilni, a drugi fidrofilni (Wilson i sar., 1981).
Izraz “emulzija“ koristi se da bi se opisali proizvodi od mesa u kojima je mast dispergovana matriksom proteina mesa. Mesne emulzije nisu klasične emulzije zato što je jedna od faza mast, druga meso, a treća faza je emulzija masti-u-vodi. Kao i kod ostalih emulzija i kod mesne emulzije potrebna je odgovarajuća stabilnost ovih sistema kako bi se izbeglo razdvajanje masti ili vode u toku toplotne obrade i drugih faza u toku procesa proizvodnje (Varnam i Sutherland, 1995).
U emulgovanju učestvuju tri tipa proteina mesa (Wilson i sar., 1981) :
a) Sarkoplazmatski proteini (i proteini ćelijskog zida) koji su rastvorljivi u vodi, ali ne i u jakim (0.5M) slanim rastvorima
Oko jedne trećine ukupnih preoteina mišića nalazi se u sarkoplazmi. A pošto je u sarkoplazmi prisutna voda i određena količina soli, svi proteini sarkoplazme su rastvorni u sarkoplazmatičnoj tečnosti, a po rastvorljivosti se dele na: rastvorne u vodi – albumine i rastvorne u razblaženim rastvorima soli – globuline (Rede i Petrović, 1997).
b) Aktini i miozin, koji su rastvoljivi u jakim slanim rastvorima, ali ne u vodi
Miofibrilarni proteini su zastupljeni sa nešto više od 50%, a po nekim autorima i nešto više od 60%, u ukupnim proteinima mišićnog tkiva. Po mišljenju nekih istraživača: 97% su odgovorni za sposobnost vezivanja vode, 75-90% za emulgujuću sposobnost mesa, 50-100% za promenu mekoće mesa i oko 70% za biološku vrednost mesa (Rede i Petrović, 1997).
c) Drugi proteini, npr. miogobin koji je rastvorljiv i u slanim rastvorima i u vodi.
Generalno gledano proteini rastvorljivi u slanim rastvorima su znatno efikasniji emulgujući agensi od u vodi – rastvorljivih proteina (Wilson i sar.,1981).
I sarkoplazmatski i miofibrilarni proteini mogu da obave emulgovanje, međutim, samo su miofibrilarni proteini apsorbovani u međufazi voda/mast (Petrović Ljiljana, 2000).
Proteini koji formiraju inter fazu voda/mast mogu da obave tu funkciju samo jednom, pa ako se u toku izrade emulzije ta interfaza prekine, moraju da se „traže“ novi proteini za obnovu interfaze (Petrović Ljiljana, 2000).
Za svojstva i ponašanje ovakvih dasperznih sistema od najvećeg značaja su: sastav, pH, sadržaj elektrolita i viskozitet kontinualne faze i veličina, oblik, mehanička svojstva i zapreminska koncentracija disperzne faze. Viskozitet kontinualne faze zavisi u prvom redu od količine i vrste rastvorenih proteina. Prema tome, količina i svojstva mišićnih proteina u mesu su najznačajniji za formiranje stabilnog matriksa i glavni su nosioci njenog formiranja, a sarkoplazmatski proteini mogu doprineti prevlačenju te strukture (Petrović Ljiljana, 2000).
Rastvorljivost mišićnih proteina zavisi od mnogih faktora, među kojima praktični značaj imaju (Petrovic Ljiljana, 2000.) :
– fiziološko stanje, tj. faza u kojoj se nalazi meso post mortem;
– stepen usitnjenosti;
– jonska jačina rastvora;
– vrsta soli;
– pH;
– trajanje ekstrakcije.
Količina rastvorenih proteina je najveća kod toplog mesa, u kojem još ima dosta nerazgrađenog ATP-a, a najmanja kod mesa u stanju rigora. Najznačajniji uticaj ispoljava jonska jačina i vrsta dodate soli. Zna se, da su fibrilarni proteini praktično nerastvorljivi pri jonskoj jačini koja vlada u mišićima, za njihovu rastvorljivost je potrebna jonska jačina od najmanje 0,5-0,6 , što se obezbeđuje koncentracijom soli 4-4,5% (Petrović Ljiljana, 2000).
Prema Petrović Ljiljani (2000), proteini mogu efikasno da suspenduju mast zbog hidrofilnih grupa koje se vezuju sa vodom i liofilnih grupa koje se vezuju za mast. I sarkoplazmatski i fibrilarni proteini mogu da obave emulgovanje, međutim, samo su miofibrilarni proteini apsorbovani u međufazi voda/mast.
Ako miofibrilarni proteini učestvuju u emulgovanju, oni gube SVV. Zbog toga, ako su svi fibrilarni proteini iskorišćeni za emulgovanje, SVV gotovog proizvoda je mala. Kada se jednom sve čestice obaviju proteinima, tada se formira mesna emulzija. Ona se stabilizuje tek denaturacijom proteina pri toplotnoj obradi. Pri denaturaciji miofibrilarni proteini formiraju veoma čvrst gel, dok sarkoplazmatski daju mekan gel i zato oni ne doprinose stabilnosti proizvoda (Petrović Ljiljana, 2000).
Pri istovremenom prisustvu stranih proteina, i proteina mesa, postavlja se pitanje koji će od njih imati prioritet prilikom emulgovanja. Kod mlečnih proteina (kazeinata), dokazano je da oni imaju prioritet, tako da proteini mesa ostaju očuvani (Schut, 1972). Time se postiže veća stabilnost i bolja konzistencija gotovog proizvoda, „štede“ se proteini mesa rastvorljivi u soli, te služe kao stabilizator mesne emulzije.
Spisak korišćene literature možete naći u Literatura – Tehnologija mesa.