Autor: Dr Vladimir Tomović
.
Atomska apsorpcija
Atomi u energetski osnovnom stanju (Me) mogu da prime određen iznos energije (hν) i da pri tom pređu u određeno energetski više stanje, tzv. ekscitovano stanje (Me*).
Me + h*ν↔Me*
Količina energije koja može da izazove prelaz atoma u ekscitovano stanje zavisi od elektronske strukture atoma u osnovnom stanju, odnosno od vrste elementa.
Ako se kroz paru atoma u osnovnom stanju nekog elementa propuštaju elektromagnetni zraci, koji imaju upravo onoliku energiju koja je potrebna za izazivanje ekscitacije atoma (elektromagnetni zraci rezonantne talasne dužine), doći će do apsorpcije ovih zraka. U ekscitovanom stanju atomi ostaju oko 10-8 sekundi, nakon čega se ponovo vraćaju u osnovno stanje, oslobađajući se viška energije delimično (preko sudara) kao toplotne energije, a delimično u vidu elektromagnetnog zračenja u okolni prostor. Veličina apsorpcije, tj. smanjenje iztenziteta propuštene svetslosti rezonantne talasne dužine, zavisiće od broja atoma u osnovnom stanju – „atomskoj pari“ – što je i osnova za primenu atomske apsorpcije u analitičke svrhe.
.
Širina rezonantne i atomske apsorpcione linije
Između zakonitosti apsorpcije svetlosti molekula i atoma postoji velika sličnost ali se za merenje atomske apsorpcije ne mogu primeniti uobičajeni spektrofotometri bez prethodnih izmena. Uzrok ovome je razlika između dva spektra. Širina molekularne apsorpcione linije je za nekoliko reda veličine veća od širine atomske apsorpcione linije. Zato se kod merenja molekularne apsorpcije postižu zadovoljavajući rezultati primenom spektrofotometara sa kontinualnim izvorom svetlosti čiji se svetlosni zraci razlažu pomoću monohromatora.
Da bi se mogla meriti atomska apsorpcija, spektrofotometri moraju imati izvor rezonantnog elektromagnetnog zračenja, čija je širina linije reda veličine kao što je širina apsorpcione linije atoma. Taj zahtev ispunjava jedino rezonantna linija iz emisionog spektra datog elementa.
Rezonantne linije atomskih emisionih spektara nisu geometrijske linije, već imaju oblik sličan Gauss-ovoj krivi raspodele sa određenim maksimumom intenziteta i polutalasnom širinom (širina linije merena na polovini maksimalnog intenziteta).
Rezonantne linije imaju svoju prirodnu širinu, koja se predstavlja pomoću polutalasne širine (Δλ1/2pri.):
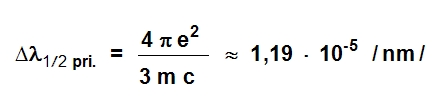
gde je: e – naelektrisanje elektrona, m – masa elektrona, c – brzina svetlosti.
Ova prirodna širina linije se praktično proširuje usled različitih uticaja, kao što je termičko kretanje i sudari atoma.
Proširenje linije koja se javlja usled termičkog kretanja atoma naziva se Doppler-ov efekat (Δλ1/2D):
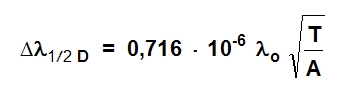
gde je: T – apsolutna temperatura, A – atomska težina, λo – talasna dužina linije.
Doppler-ov efekat ne izaziva promenu maksimalnog intenziteta linije već izaziva samo njeno proširenje.
Proširenje usled međusobnih sudara atoma često izaziva i deformaciju oblika emitovane linije (takođe i apsorbovane linije) kao i njeno pomeranje ka većim talasnim dužinama. Usled međusobnog dejstva naelektrisanih čestica nastaje tzv. Stark-ov efekat, dok pri međusobnom sudaru nenaelektrisanih čestica nastaje Van der Waals-ovo proširenje. Usled sudara atoma iste vrste nastaje Holtsmark-ovo proširenje. Ova tri efekta je vrlo teško razlikovati i zato se oni svi zajedno obično nazivaju Lorenz-ovo proširenje (Δλ1/2 L):
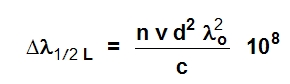
gde je: n – broj atoma po jedinici zapremine, v – srednja brzina atoma, d -prečnik korisnog sudara.
Širina emisione rezonantne linije je oko 0,002 nm.
Slično emisionim linijama i atomske apsorpcione linije imaju određene širine. Širina apsorpcionih linija atoma je obično nešto šira od emisionih linija.
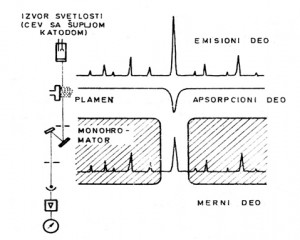
Da bi se mogla meriti atomska apsorpcija, potrebno je imati monohromatski izvor svetlosti stalnog intenziteta rezonantne talasne dužine za određeni element, čija je polutalasna širina manja od polutalasne širine atomske apsorpcione linije. Ove zahteve izvora svetlosti zadovoljava cev sa šupljom katodom. Pod ovakvim uslovima tačnost merenja ne određuje monohromator, u atomskom apsorpcionom spektrofotometru već kvalitet cevi sa šupljom katodom (ili drugi odgovarajući izvor svetlosti) i tačnost merenja intenziteta propuštene svetlosti nakon atomske apsorpcije. Monohromatori obično propuštaju traku monohromatskog zraka čija je polutalasna širina oko 0,5 nm, dok je polutalasna širina atomske apsorpcione linije oko 0,01 nm. Time je uloga monohromatora svedena samo na izolovanje rezonantne linije iz „okoline“, što je i šematski prikazano na Slici 1.1.
.
Aparati za merenje atomske apsorpcije
Atomski apsorpcioni spektrofotometri mogu da se podele prema sastavnim delovima na četiri osnovna dela:
1. Emisioni deo – predstavlja pogodni izvor svetlosti rezonantne talasne dužine,
2. Apsorpcioni deo – ili deo za atomizaciju,
3. Selekcioni deo – ili monohromator,
4. Merni deo – sastoji se od detektora, sistema za pojačavanje signala i mernog instrumenta.
Zavisno od toga kako se vrši atomizacija atomski apsorpcioni spektrofotometri se mogu podeliti na dve velike grupe:
a) Aparati kod kojih se atomizacija vrši pomoću plamena,
b) Aparati sa bezplamenim atomizerima.
Ovi aparati su novije proizvodnje, ali su već vrlo rasprostranjeni zbog veće osetljivosti određivanja i pojave znatno manjeg broja smetnji u odnosu na klasične plamene atomske apsorpcione spektrofotometre, ali su zato i znatno skuplji. Sam proces atomizacije se najčešće vrši pomoću električnog luka u grafitnim kivetama, katodnim isparavanjem ili pomoću laserskih zraka.
Zbog pristupačnije cene najrasprostranjeniji su atomski apsorpcioni spektrofotometri za atomizaciju u plamenu.
.
Emisioni deo
Emisioni deo obuhvata sistem za električno napajanje izvora svetlosti i izvor svetlosti rezonantnog zračenja. Kako ne postoji monohromator koji može proizvesti linije sa širinom manjom od 10-3 nm, to se u AAS kao izvor svetlosti najčešće koristi lampa (cev) sa šupljom katodom.
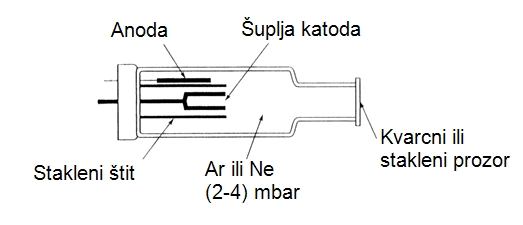
Cev sa šupljom katodom (Slika 2.1.)se sastoji od staklenog cilindra u kojem je smeštena šuplja katoda čija je unutrašnja površina prevučena elementom koji se ispituje.
Anoda je od volframa. Nasuprot katode je smešten kvarcni prozor, za one elemente koji imaju rezonantnu talasnu dužinu u bliskoj ultraljubičastoj oblasti, ili stakleni prozor, za one elemente koji imaju rezonantnu liniju u vidljivoj oblasti spektra. U staklenom cilindru se nalazi neki inertni gas, najčešće argon, pod malim pritiskom (2-4 mbara). Inertni gas služi kao energetski pufer, jer jonizacioni potencijal gasa određuje maksimalnu energiju ekscitacije. Na ovaj način se sprečava pojava drugih rezonantnih linija, koje zahtevaju veću energiju ekscitacije.
Usled saopštene razlike potencijala između anode i katode, dolazi do jonizacije inertnog gasa. Stvoreni joni „bombarduju“ unutrašnju površinu šuplje katode, te dolazi do izbijanja atoma ispitivanog elementa. Usled međusobnih sudara atoma i sudara sa jonima inertnog gasa, dolazi do ekscitacije atoma ispitivanog elementa, a nakon toga do emisije elektromagnetnih zraka rezonantne talasne dužine.
Do danas su uspešno konstruisane cevi sa šupljom katodom za veliki broj elemenata (metala). Cevi sa šupljom katodom nisu konstruisane za elemente koji imaju rezonantnu liniju u oblasti ispod 190 nm (vakuumska UV oblast), jer je spektrofotometrijsko merenje u ovoj oblasti teško izvodljivo (potreban je vakuum), a to su elementi C, H, N, O, S, P, halogeni elementi i inertni gasovi.
.
Apsorpcioni deo
Uloga apsorpcionog dela atomskog apsorpcionog spektrofotometra je da stvara atome ispitivanog metala u osnovnom stanju, koji će apsorbovati upadnu svetlost iz izvora svetlosti. Ovaj deo je ujedno i najvažniji deo atomskog apsorpcionog spektrofotometra, jer osetljivost određivanja neposredno zavisi od broja nastalih atoma metala u osnovnom stanju po jedinici zapremine kroz koju prolazi rezonantni svetlosni zrak, odnosno od efikasnosti atomizacije.
.
Atomizacija pomoću plamena
Da bi došlo do apsorpcije elektromagnetnih zraka rezonantne talasne dužine, ispitivani element se mora prevesti u atomsko stanje. Atomizacija se izvodi pomoću toplotne energije plamena ili drugih bezplamenih metoda. U slučaju primene plamena, najjednostavniji način uvođenja ispitivanog metala u plamen je da se pripremi njegov rastvor koji se zatim raspršuje pomoću pneumatskog raspršivača i u vidu finih kapljica rastvora (aerosola) uvodi u plamen.
.
Termička disocijacija
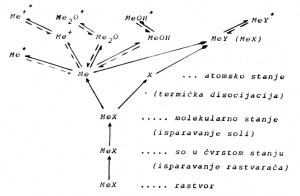
U plamenu se pod dejstvom toplotne energije odvijaju sledeći procesi (Slika 2.2.):
– rastvarač isprava, pri čemu so metala ostaje u čvrstom stanju;
– so ispitivanog metala isparava (sublimuje) u molekularno stanje;
– molekuli disociraju na atome (termička disocijacija);
– pojedini atomi prelaze u ekscitovano stanje;
– neki atomi metala gube svoje valentne elektrone i prelaze u jonizovano stanje;
– deo atoma se jedini sa nekim anjonima u molekule, ili se stvaraju oksidi ili hidroksidi, koji takođe mogu da pređu u ekscitovano stanje.
Odnos broja atoma u ekscitovanom stanju (Nj) i u osnovnom stanju (No) može se izračunati na osnovu statističke mehanike u zavisnosti od temperature (T):
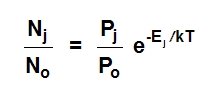
Pj i Po su tzv. statističke težine, koje pripadaju dvema vrstama stanja atoma. Ej je energija potrebna za ekscitaciju na temperaturi T, dok je k Boltzmann-ova konstanta.
Međutim, udeo atoma koji se pobuđuje i jonizuje znatno je manji od udela atoma koji ostaju u nepobuđenom stanju u atomskoj pari ((Nj << No) → (No = N), N – ukupan broj atoma stvorenih nakon disocijacije), i upravo je ovaj udeo od značaja za metodu atomske apsorpcione spektrofotometrije, i čini je osetljivom i reproduktivnom analitičkom metodom.
.
Plamen i plamenici
Plamen u procesu atomizacije ne može se posmatrati samo kao izvor potrebne toplotne energije, već i kao sredina koja i svojim sastavom aktivno utiče na proces atomizacije. Atomi metala u plamenu stupaju u reakciju sa sastavnim delovima plamena, te ravnotežne reakcije koje nastaju određuju koncentraciju slobodnih atoma. Na pojedinačne ravnotežne reakcije naročito utiču u malim količinama prisutni radikali i slobodni atomi.
Plamen nema ulogu pobudnog izvora, naprotiv, treba težiti tome da broj pobuđenih atoma u „atomskoj pari“ bude što manji.
U atomskoj apsorpcionoj spektrofotometriji uglavnom se primenjuje laminarni plamen. Izbor smeše gasova zavisi od osobine ispitivanog metala. Najvažnije smeše za sagorevanje njihove radne temperature i metali za koje su ove smeše najpogodnije date su u Tabeli 2.1.
Tabela 2.1. Smeše za sagorevanje
| Goreći gas | Gas koji pomaže sagorevanje – Oksidant |
Približne temperature (°C) |
Elementi za koje je plamen pogodan |
| Vodeni gas | Vazduh | 1800 | Alkalni metali, Zn, Cu, Cd, Pb |
| Propan | Vazduh | 1900 | Kao gore + drugi isparljivi elementi i plemeniti metali |
| Acetilen (smeša siro-mašna acetilenom) | Vazduh | 2300 | Najbolja za zemnoalkalne metale |
| Acetilen (smeša bogata acetilenom) | Vazduh | 2300 | Sn, Ba, Cr i dr. |
| Azot-suboksid | Acetilen | 2955 | Metali koji grade teško isparljive okside i hidrokside kao što su: Al, Si, Ti, V, Zr, Ge, Be i dr. |
Najuniverzalnije korišćen plamen je vazduh/acetilen, mada plamen vazduh/propan daje veću osetljivost za alkalne i druge elemente koji lako ekscituju i jonizuju, dok je plamen smeše azot-suboksid/acetilen neophodan za elemente koji grade teško isparljive okside i hidrokside.
Plamenici za atomsku apsorpcionu spektrofotometriju su obično izduženog oblika. Izduženi oblik plamenika, odnosno plamena izabran je zato da bi se obezbedio što duži put svetlosti od svetlosnog izvora kroz plamen i time povećala osetljivost određivanja. Dužina otvora plamenika ne prelazi 10-12 cm, jer dalje povećanje otvora izaziva fluktaciju plamena, a i brzina protoka gasa bi se smanjila na krajevima otvora plamenika.
.
Sistem za raspršivanje – Nebulizer
Sistem za raspršivanje ima vrlo značajnu ulogu u osetljivosti određivanja plamenom atomskom apsorpcionom spektrofotometrijom. Na osetljivost određivanja u velikoj meri utiče količina rastvora koja dospeva u plamen u jedinici vremena kao i veličina i ujednačenost (homodisperznost) kapljica raspršenog rastvora. Povećanjem količine rastvora koji dospeva u plamen, smanjenjem veličine kapljica i povećanjem homodisperznosti povećava se osetljivost atomske apsorpcione spektrofotometrije.
Za raspršivanje rastvora se uglavnom koriste pneumatični raspršivači, pri čemu se gas koji potpomaže sagorevanje gorećeg gasa, obično vazduh, koristi za raspršivanje.
U atomskoj apsorpcionoj spektrofotometriji koriste se tzv. posredni raspršivači. Za razliku od neposrednih raspršivača, kod kojih se rastvor neposredno raspršuje u plamen, rastvor se kod posrednih tipova raspršivača raspršuje u jednoj komori.
U rastvor ispitivane supstance uronjena je kapilarna cevčica, čiji je drugi kraj izložen struji oksidacionog gasa (obično vazduh). Pod dejstvom strujanja vazduha na kraju kapilarne cevčice stvara se vakuum, pri čemu se ispitivani rastvor usisava i raspršuje u komoru u obliku finih kapi.
Komore u kojima se vrši raspršivanje, u literaturi se nazivaju kondenzacione ili homogenizacione komore. U ovim komorama pored stvaranja smeše sa gorećim gasom (obično acetilen), koja odlazi kroz plamenik, gde se pod uticajem temperature plamena ispitivana supstanca prevodi u atomsko stanje, dolazi i do taloženja većih kapljica čime se obezbeđuje da u plamen dospeju samo sitne i ujednačene veličine kapljica, što povećava osetljivost određivanja. U cilju poboljšavanja mešanja gasova i ubrzanja taloženja kapljica većih prečnika, u kondenzacione komore se često ugrađuju pera za ometanje protoka gasa.
U nekim atomskim apsorpcionim spektrofotometrima (npr. Pye Unicam SP 90 A serija 2) postoji mogućnost postavljanja jedne kuglice ispred raspršivača u cilju povećanja efikasnosti raspršivanja. Raspršene kapi iz raspršivača udaraju u površinu kuglice i na taj način dolazi do dodatnog raspršivanja kapi, odnosno do smanjivanja prečnika kapi.
Mana posrednih sistema za raspršivanje je što relativno mala zapremina raspršenog rastvora (oko 10%) dospeva u plamen, jer se veći deo raspršenog rastvora kondenzuje i preko odvodne cevi kondenzacione komore izvodi kao neupotrebljiv rastvor za dalje određivanje.
.
Selekcioni i merni deo
Selekcioni i merni deo atomskog apsorpcionog spektrofotometra u suštini odgovara selekcionom i mernom delu UV i vidljivih spektrofotometara. Šta više, uloga selekcionog dela je kod atomskih apsorpcionih spektrofotometara znatno smanjena, jer izvor svetlosti već obezbeđuje potrebni monohromatski zrak, a monohromator ga samo nakon atomske apsorpcije ponovo izdvaja iz okolnog spektra.
Kao monohromatori kod atomskih apsorpcionih spektrofotometara se većinom koriste prizme, a ređe difrakcione rešetke. Korisni interval spektra monohromatora treba da je od 190 do 850 nm. Prizme i delovi propusni za svetlost se izrađuju od kvarcnog stakla. Zahtevi u pogledu disperzije i moći razdvajanja monohromatora takođe odgovaraju onima potrebnim za UV spektrofotometre srednjih kvaliteta, jer je analitički kvalitet instrumenta određen pre svega intenzitetom izvora svetlosti, a zatim kvalitetom monohromatora i osetljivošću detektora.
Kao detektor se koristi fotoćelija ili fotomultiplikator. Ugradnja osetljivijeg fotomul-tiplikatora ne povećava analitičku osetljivost instrumenta, ali povećava odnos signal/šum, što povećava preciznost konačnog merenja.
.
Osetljivost i tačnost određivanja
Atomskom apsorpcinom spektrofotometrijom se mogu neposredno određivati svi oni elementi čije se rezonantne linije nalaze u oblasti od 190 do 850 nm (bliska ultravioletna i vidljiva oblast spektra) i koji se mogu prevesti u osnovno atomsko stanje. Ovim uslovima uglavnom odgovaraju metali.
Osetljivost u atomskoj apsorpcionoj spektrofotometriji je definisana kao onaj sadržaj vodenog rastvora ispitivanog elementa, u μg/ml (ppm), koji izaziva apsorpciju od 1%. Pri eksperimentalnim određivanjima, poznavanje osetljivosti je veoma koristan podatak za pripremu uzorka i standardnih rastvora, jer se optimalni interval određivanja obično nalazi u rasponu od 20 do 200 puta većim koncentracijama od osetljivosti za dati element.
Mnogo značajniji pojam je granica detekcije. Vrednost granice detekcije ne zavisi samo od vrednosti merenog signala, nego i od vrednosti „šuma“ aparata. Granica detekcije definiše se onim sadržajem elementa u rastvoru koji izaziva dvostruko veći signal od signala „šuma“ aparata.
Osetljivost i granica detekcije aparata veoma se razlikuju za pojedine elemente. Ova razlika potiče od razlika između apsorpcionih koeficijenata elemenata, ali zavisi i od osobina elementa u procesima koji se dešavaju pri dovođenju u atomsko stanje.
Optimalna osetljivost i tačnost mogu se postići kada se, prethodnim ispitivanjima, za dati aparat i element koji se određuje, nađu najpogodniji uslovi raspršivanja, najpogodniji sastav gorućeg gasa i gasa koji potpomaže sagorevanje, njihova brzina strujanja, visina plamena i intenzitet izvora svetlosti.
Tačnost određivanja atomskom apsorpcionom spektrofotometrijom definiše se relativnom greškom određivanja koncentracije (Δc• 100/c). Pri vrlo pažljivom radu, vodeći računa o činjenici da su najtačnija merenja apsorbancije u intervalu apsorbancije od 0,2 do 0,8, može se postići minimalna greška od 0,3 do 0,8%.
.
Smetnje
Atomska apsorpciona spektrofotometrija spada u relativne metode, tj u metode pri kojima se, pomoću rastvora poznatih koncentracija (standardnih rastvora), određuje nepoznata koncentracija ispitivanog elementa u rastvoru pomoću kalibracionog grafa.
Usled različitog hemijskog sastava standardnih rastvora i uzorka, mogu nastati različite greške. Ove greške se manifestuju time da se pri istovetnim koncentracijama posmatranog elementa u standardnom rastvoru i rastvoru uzorka, atomizacijom dobija različiti broj atoma sposobnih za apsorpciju.
Smetnje koje se javljaju u plamenoj atomskoj apsorpcionoj spektrofotometriji dele se na:
- Spektralne smetnje
- Hemijske smetnje
- Smetnje usled apsorpcije pozadine
- Jonizacione smetnje
- Fizičke smetnje
.
Spektralne smetnje
Atomska apsorpciona spektrofotometrija je veoma selektivna i specifična metoda. Talasne dužine, na kojima apsorbuju pojedini elementi, dobro su definisane, a mogućnost da dva elementa apsorbuju na istoj talasnoj dužini je neznatna. Primenom modulacije emitovane svetlosti sa šupljih katodnih lampi i usklađenog pojačavanja ove modulovane frekvencije, praktično je eliminisana mogućnost pojave spektralnih smetnji.
.
Hemijske smetnje
Hemijskim smetnjama se naziva svako obrazovanje hemijske veze posmatranog elementa koja ometa kvantitativnu termičku disocijaciju (atomizaciju). Kvantitativna atomizacija praktično se postiže iz neutralnih ili slabo kiselih vodenih rastvora hlorida ili nitrata ispitivanih metala, pod optimalno podešenim uslovima.
Hemijske smetnje se prema uzročnicima dele na katjonske i anjonske, a prema mehanizmu njihove pojave na dve grupe:
a) Hemijske smetnje koje nastaju kada termička disocijacija ispitivanog elementa nije kvantitativna. To se događa kada u plamenu nastaju teško topljive soli ili teško isparljive soli koje termički ne disociraju u potpunosti.
b) Hemijske smetnje koje nastaju usled toga što atomi ispitivanog elementa u osnovnom stanju, nakon svog nastanka, vrlo brzo reaguju sa drugim atomima ili radikalima u plamenu, pa atomi nisu dovoljno dugo u osnovnom stanju i ne mogu apsorbovati svetlosne zrake rezonantne talasne dužine.
Pojava druge grupe hemijskih smetnji je vrlo karakteristična za atomizaciju u plamenu. Pojava ovog tipa smetnji zavisi od hemijskog sastava i afiniteta posmatranog atoma prema mogućim partnerima za reakciju u plamenu. Pri ovoj smetnji posmatrani atomi najčešće grade okside ili oksidne radikale, hidrokside ili hidroksilne radikale, karbide i nitride. Ovo je uzrok da oko 30 elemenata, među koje spadaju svi lantanidi, zatim elementi kao Al, Si, B i drugi, imaju vrlo malu osetljivost određivanja u plamenu, jer spontano grade okside.
Veći broj hemijskih smetnji može se izbeći ili smanjiti povišenjem temperature plamena i izborom pogodnije hemijske okoline (sastav plamena) pri atomizaciji. Tako se veći deo hemijskih smetnji koje se javljaju u plamenu acetilen/vazduh može izbeći primenom redukujućeg plamena acetilen/azot-suboksid, koji pored više temperature (oko 2750°C) poseduje pogodniji hemijski sastav, dok se, na primer u plamenu acetilen/kiseonik, koji ima još višu temperaturu (oko 3050°C), nasuprot očekivanju, povećava broj i intenzitet hemijskih smetnji, zbog izrazito oksidacionih osobina plamena.
Kada hemijske smetnje ne mogu da se izbegnu na pomenuti način, tada se primenjuje jedna od sledećih metoda:
- Izjednačavanje sastava (matriksa) standardnih rastvora sa sastavom rastvora uzorka.
- Vezivanje jona koji izaziva smetnje dodavanjem pogodnog katjona ili anjona („reagens za oslobađanje“) u višku.
- Ispitivani element u rastvoru se kompleksiranjem zaštićuje od mogućnosti stvaranja neke druge hemijske veze, koja bi izazvala pojavu hemijskih smetnji.
Prva metoda primenjuje se kada smetnja nije intenzivna i kada je matriks uzorka jednostavan. Primer primene ove metode je izjednačavanje kiselosti standardnih rastvora sa rastvorom uzorka.
Ako matriks u uzorku izaziva znatnu smetnju, primena metode izjednačavanja sastava se ne preporučuje jer će izazvati smanjenje osetljivosti određivanja ispitivanog elementa.
Druga metoda za uklanjanje hemijskih smetnji verovatno se najčešće primenjuje u praktičnom radu. U rastvor uzorka dodaje se odgovarajući katjon koji će stvarati stabilnije jedinjenje sa anjonom ispitivanog elementa koji izaziva smetnje. Na ovaj način ispitivani element se oslobađa i može da se kvantitativno atomizuje u plamenu. Slično ovome, može se dodati i neki anjon u rastvor uzorka, ako neki katjon izaziva smetnju. Prilikom primene ove metode, u standardne rastvore se takođe dodaje „oslobađajući reagens“ u istim količinama kao i u rastvore uzorka, i ako u njima nema anjona ili katjona koji izazivaju smetnje.
Treća metoda je slična drugoj, s tom razlikom što se ovde ispitivani elemenat u rastvoru vezuje u jedan stabilan, hemijski rezistentan i malo disocirajući kompleks. Na ovaj način ispitivani metal se zaštićuje „zaštitnim ogrtačem“ kompleksnog jedinjenja od mogućnosti vezivanja sa anjonima koji izazivaju smetnje. Kompleksno jedinjenje u plamenu se lako razara i oslobađa se metalni atom. Najčešće se kao kompleksirajuće jedinjenje primenjuje EDTA.
.
Smetnje usled apsorpcije pozadine
Do pojave ove smetnje (Background ili Matrix interference) dolazi usled rasipanja svetlosti na čvrstim ili tečnim česticama prisutnim u plamenu i usled apsorpcije svetlosti od strane molekula ili radikala u plamenu. Uzročnici pojave ovog tipa smetnji većinom potiču iz matriksa uzorka.
Efekti rasipanja svetlosti na čvrstim ili tečnim česticama, iako nemaju veze sa apsorpcijom, uvrštavaju se u smetnje usled apsorpcije pozadine, jer su njihovi krajnji efekti slični ovome tipu apsorpcije, a i način njihove kompenzacije, odnosno eliminisanja, istovetan je.
Ispitivanja su pokazala da se ovaj tip smetnji vrlo retko javlja primenom posrednih raspršivača sa dobro konstruisanim kondenzacionim komorama, ako je ukupan sadržaj soli u rastvoru ispod 5% i ako je radna talasna dužina iznad 300 nm.
Drugi efekt je prava apsorpcija svetlosti od strane molekula i radikala u plamenu. Do smetnji dolazi kada rezonantna linija ispitivanog elementa pada u oblast molekularne apsorpcije molekula ili radikala koji se nalaze u plamenu. Do pojave većeg broja molekula u plamenu dolazi kada je plamen niže temperature, kada se određuju elementi koji se lako atomizuju u prisustvu teško atomizirajućeg matriksa, ili ako neki elemenat, koji se nalazi u većim koncentracijama u matriksu, gradi sa gasovima plamena oksidne molekule ili hidroksilne radikale.
U modernijim atomskim apsorpcionim spektrofotometrima ugrađena je jedna deuterijumova lampa kao izvor UV svetlosti. Pomoću UV svetlosti meri se vrednost smetnji usled apsorpcije pozadine i automatski se obavlja kompenzacija merenog signala na rezonantnoj liniji posmatranog elementa.
.
Jonizacione smetnje
U plamenu visoke temperature (posebno u plamenu azot-suboksid/acetilen, a delimično i u plamenu vazduh/acetilen), dolazi do znatne jonizacije atoma većeg broja metala, a naročito onih metala koji imaju niže jonizacione potencijale. Jonizovani atomi više ne apsorbuju rezonantno elektromagnetno zračenje, što dovodi do smanjenja osetljivosti, a i do greške u merenju, ako je stepen jonizacije posmatranog metala iz rastvora uzorka i standardnog rastvora različit.
U plamenu postoji ravnoteža između atoma u osnovnom stanju i jona:
Me ↔ Men+ + ne-
Do različitog stepena jonizacije posmatranog metala u plamenu dolazi zbog različitog sastava ispitivanih rastvora, a samim tim i različitog sastava plamena.
Ako je u rastvoru (najčešće u uzorku) prisutan neki drugi elemenat koji u datom plamenu takođe jonizuje, doći će do povećanja koncentracije elektrona u plamenu i time će biti suzbijena jonizacija posmatranog metala.
Pojava jonizacije je i uzrok zakrivljenja kalibracione krive ka osi apsorbancije.
Iz navedenih razloga, pokazalo se neophodnim eliminisanje pojave jonizacije, naročito onih elemenata koji imaju niže jonizacione potencijale (alkalni i zemnoalkalni metali). Najjednostavniji način uklanjanja pojave jonizacije, a time i smetnje koju ona izaziva, jeste primena plamena nižih temperatura. Na žalost, ovaj vrlo efikasan način uklanjanja jonizacije često nije primenljiv, jer se u plamenu niže temperature dati elemenat ne može određivati (npr. lantanidi). Zbog toga se najčešće primenjuje metoda pri kojoj se u rastvor uzorka i u standardne rastvore dodaje u velikom višku neki elemenat niskog jonizacionog potencijala (jonizacioni pufer), koji će u plamenu jako jonizovati, najčešće kalijum ili cezijum. Jonizacioni pufer povećava koncentraciju elektrona u plamenu i time suzbija jonizaciju posmatranog elementa.
.
Fizičke smetnje
Uopšteno se fizičke smetnje definišu kao smetnje koje se javljaju usled različitih fizičkih dejstava na procese atomizacije posmatranog elementa iz rastvora uzorka i iz standardnih rastvora. U fizičke smetnje spadaju već opisane smetnje usled apsorpcije pozadine, rasipanja svetlosti i jonizacije, koje su posebno izdvojene zbog svoje specifičnosti.
Fizičkim smetnjama će se smatrati samo one smetnje koje nastaju usled različitih fizičkih osobina rastvora uzorka i standardnih rastvora, tj. usled razlike u viskoznosti, površinskom naponu i gustine rastvora.
Ove razlike u velikoj meri utiču na brzinu raspršivanja i na veličinu raspršenih kapljica, a time i na osetljivost određivanja.
Ako u rastvoru ispitivanog uzorka, pored posmatranog elementa, postoji velika koncentracija (iznad 1%) neke soli ili kiseline, tada se već javljaju fizičke smetnje. Smatra se da u ovakvim slučajevima već dolazi do promene fizičkih osobina rastvora u odnosu na standardne vodene rastvore posmatranog elementa, pa se smanjuje brzina raspršivanja i povećava prosečna veličina raspršenih kapljica. Ukupni efekat ovog dejstva je smanjenje osetljivosti određivanja, tj. pojave greške u određivanju, ako standardni rastvori ne sadrže istu koncentraciju soli. Ako umesto neorganskih soli ima više od 1% organskih jedinjenja (npr. belančevina, šećera, itd.), efekat smetnje je znatno izraženiji, iako je najčešće kombinovan sa pojavom hemijskih smetnji.
Organske supstance (rastvarači) mogu već i veoma malim koncentracijama u rastvoru metala da izazovu smetnje, pri čemu mogu izazvati ili povećanje ili smanjenje osetljivosti (mernog signala). U literaturi se može naći veliki broj objašnjenja načina na koji različite organske materije izazivaju smetnje.
- Izazivaju promenu uslova raspršivanja rastvora. To je čista fizička smetnja koja najčešće nastaje usled promene površinskog napona ili viskoziteta rastvora.
- Utiču na promenu temperature plamena (termički efekat).
- Izazivaju redukcioni efekat u plamenu, jer njihovim sagorevanjem povećava se koncentracija ugljeničnih radikala u plamenu.
- Izazivaju prave hemijske smetnje stvaranjem organskih jedinjenja sa metalima, kompleksa ili helata.
Zavisno od osobina ili koncentracije organskog jedinjenja, pomenuti načini dejstva mogu biti manje ili više izraženi u sumarnom dejstvu smetnji.
.
Priprema (razaranje) uzorka
U većini laboratorija za hranu, uzorci se prethodno tretiraju mokrim ili suvim postupkom razaranja pre određivanja tragova metala u ostatku. Poželjno je potpuno razaranje uzorka, i neophodno je odabrati postupak kojim se to postiže bez kontaminacije i značajnih gubitaka. I mokri i suvi postupak razaranja su uobičajeni, i često je teško odlučiti se za jedan. Gorsuch je pažljivo ispitivano metode mokrog i suvog razaranja i našao je malo razloga za davanje prednosti jedne nad drugom.
Prednost mokrog postupka razaranja je što je dosta brz, potrebna je jednostavna aparatura i manje su sklonosti ka gubicima usled isparavanja i zadržavanja na zidovima posude zahvaljujućim „tečnim“ uslovima i niskim temperaturama. Nedostaci su: da je zbog velike količine reagenasa potrebna slepa proba, nije pogodan za velike uzorke (do 10 g) i potrebno je značajno nadgledanje.
Nasuprot tome, postupak suvog razaranja ima i prednosti i nedostatke koji su skoro suprotni postupku mokrog razaranja. Lako se radi sa velikim uzorcima, ništa ili malo reagensa se dodaje, tako da je problem slepe probe sveden na minimum i potrebno je malo nadgledanja. Problem je što je potrebno više vremena, oprema je skuplja i veća je mogućnost da dođe do gubitaka usled isparavanja i zadržavanja na zidovima posude usled visoke temperature i suvih uslova.
Na desetine ili stotine različitih postupaka je opisano u literaturi za razaranje organskih uzoraka, mnogi od njih se razlikuju samo po nebitnim detaljima. Za navedene metode se ne tvrdi da su jedino zadovoljavajuće, takva tvrdnja bi praktično bila apsurdna. To su samo metode koje su se pokazale kao zadovoljavajuće u dosta rasprostranjenoj upotrebi.
.
Postupak mokrog razaranja
Ove metode su malo manje zavisne od prirode uzorka jer velike količine dodatog reagensa teže da potisnu uticaj raznolikosti sastava. One su stoga verovatno prvi izbor kada se radi sa novom vrstom uzorka, pa se mokri postupak oksidacije realno može preporučiti za dobijanje svakog elementa.
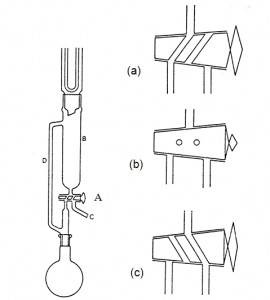
Kod tradicionalnog mokrog postupka razaranja uzorak se razgrađuje u Kjeldahl boci za spaljivanje sa dugačkim grlom.Međutim, tip aparata prikazan na Slici 5.1. ima mnogo prednosti u odnosu na tradicionalnu Kjeldahl metodu, i preporučuje se njegova upotreba. Ključna karakteristika je slavina (A) sa tri položaja, koja se koristi da se omogući refluks (položaj a) ili destilacija (položaj b) i uklanjanje destilata (položaj c). Njenom primenom, oksidacioni potencijal sistema se može stabilizovati omogućavanjem refluksa smeše kiseline, ili se može pospešiti omogućavajući destilaciju, i zatim ponovo stabilisati ispuštanjem destilata i vraćanjem u položaj za refluks. Mogu se izdvojiti frakcije destilata, sačuvati za kasnije tretmane, ili ispitati (u slobodno vreme u toku ispitivanja). U nekim slučajevima pogodno je koristiti bocu sa dva grla umesto sa jednim (kao što je prikazano), da bi se stavio termometar u bocu. Na ovaj način, dužina stupnjeva destilacije se može kontrolisati preko temperature koju dostiže reakcioni rastvor; ovo može biti posebno važno kod smeša koje sadrže perhlornu kiselinu.
Predložene su različite smeše za razaranje, ali do sada nema ni jedne smeše koja na odgovarajući način razara sve uzorke sa potpunim dobijanjem svih tragova metala.
.
Smeša azotne i sumporne kiseline
Ovo je najčešće korišćena smeša oksidacionih sredstava, i u jednoj i u drugoj opisanoj varijanti je pogodna za dobijanje praktično svih elemenata osim selena, i moguće rutenijuma i osmijuma, iz skoro svih tipova uzoraka, osim možda onih koji sadrže kovalentni hlorin. U ovom poslednjem slučaju mogu nastupiti problemi sa elementima kao što je arsen ili germanijum gde se mogu formirati isparljivi hloridi.
Problemi mogu nastati kod uzoraka bogatih kalcijumom, jer usled taloženja kalcijum-sulfata mogu nastati gubici usled koprecipitacije. Iako se većina metala dobija u potpunosti, razaranje je sporo a potpuna razgradnja masti može da traje i do 24 h; sloj masti se obično izdvoji bez razgradnje. Mnoge laboratorije još uvek koriste ovu metodu radije nego upotrebu perhlorne kiseline, koja može biti štetna u drvenim digestorima.
.
Smeše sa perhlornom kiselinom
Perhlorna kiselina se može koristiti kao mali finalni dodatak u postupku koji se uglavnom bazira na drugim oksidansima, ili kao glavni konstituent prisutan u sistemu od početka. U oba slučaja moraju se preduzeti mere zaštite kod rukovanja perhlornom kiselinom.
Ne preporučuje se da se koristi perhlorna kiselina za razgradnju osim u prisustvu viška azotne kiseline; azotna kiselina efikasno oksidiše većinu reaktivnih jedinjenja u uzorku pri srazmerno niskim temperaturama, gde perhlorna kiselina nije efikasna, i pri nastavljenom zagrevanju povećana snaga oksidacije perhlorne kiseline će delovati u pravcu dovršavanja razgradnje.
.
Postupak suvog razaranja
Mnogo je teže opisati suvu oksidaciju koja zadovoljava potrebe širokog spektra uzoraka. Verovatno da ima toliko varijacija u osnovi postupka suvog razaranja, koliko ima i prehrambenih analitičara i upoređivanje rezultata je često veoma teško, ali za davanje osnove za neophodne varijacije sledeći postupak bi trebalo da bude odgovarajući.
Suština ovog postupka je u tome da se za razgradnju organskog dela uzorka koristi atmosferski kiseonik.
.
Literatura
- Bock, R., A Handbook of Decomposition Methods in Analytical Chemistry, International Textbook Company, 1979.
- Folić, Lj., Laušević, M., Skala, D., Bastić, M., Instrumentalne metode hemijske analize – Praktikum za vežbe, Tehnološko-Metalurški fakultet, Univerzitet u Beogradu, 1980.
- Gorsuch, T.T., The Destruction of Organic Matter, Pergamon Press, 1970.
- Jankovitš, I., Uticaj sastavnih komponenata alkoholnih pića na određivanje nekih metala atomskom apsorpcionom spektrofotometrijom, Magistarski rad, Tehnološki fakultet, Univerzitet u Novom Sadu, 1979.
- Marjanović, N., Jankovitš, I., Instrumentalne metode analize, Tehnološki fakultet, Zavod za izdavanje udžbenika, Novi Sad, 1983.
- Marjanović, N., Krstić, B., Instrumentalne metode u biološkim istraživanjima, Univerzitet u Novom Sadu, 1998.
- Mišović, J., Ast, T., Instrumentalne metode hemijske analize, Tehnološko-Metalurški fakultet, Univerzitet u Beogradu, 1994.
- Rose, J.C., Food Analysis by Atomic Absorption Spectroscopy, Varian Techtron, 1973.
- Skoog, A.D., Holler, J.F., Nieman, A.T., Principles of Instrumental Analysis, Saunders College Publishing, 1992.