Autor: dipl. biolog – master Vladimir Vukić
E-mail: vladimirvukic@gmail.com
.
.
PCR metodu je 1985. godine formulisao Karl Mullis, veoma osetljiva i često se koristi u biologiji i medicini.
Umnožavanje DNK putem PCR-a se bazira na hibridizaciji specifičnih oligonukleotida (prajmera) i in vitro sintezi kopija željenog fragmenta koji je oivičen i obeležen datim prajmerima. Takvo umnožavanje je praćeno agaroznom gel elektroforezom i prestavlja najednostavniju primenu PCR-a za identifikaciju vrsta.
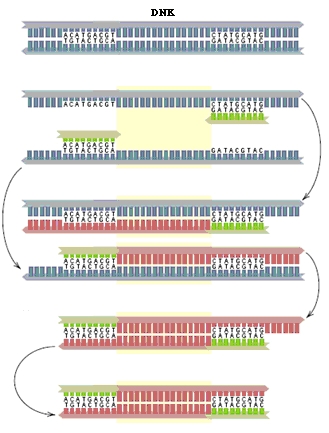
PCR predstavlja replikaciju (prepisivanje, umnožavanje) DNK molekula in vitro. Za izvođenje PCR-a neophodni su:
- DNK matrica – dvostruki DNK lanac koji sadrži informaciju koja se želi umnožiti, dužine 100-35000 baznih parova
- jednolančani prajmeri – sekvence oligonukleotida dužine 20-30 nukleotida čije su sekvence komplementarne krajevima one DNK sekvence koja se želi umnožiti
- smeša slobodnih dezoksinukleotida u zasićenim koncentracijama: 200 mM za svaki dNTP
- enzim DNK polimeraza koja vrši sintezu novih DNK lanaca
- Mg2+ joni koji su neophodni za aktivnost enzima i oni se dodaju u vidu MgCl2
- Pufer – standardni pufer koji se sastoji od 50 mM KCl, 10 mM TRIS Cl, 1.5 mM MgCl2, pH 8.3, 21 Co
U PCR metodi se koristi DNK polimeraza izolovana iz bakterije Thermus aquaticus (nazvana Taq polimeraza) koja živi u termalnim izvorima na temperaturi oko 70 oC. Usled toga je sposobna da na toj temperaturi vrši replikaciju DNK molekula.
Napravljena reakciona smeša se stavlja u aparat nazvan Termocycler koji omogućuje tok reakcije. PCR se izvodi ponavljanjem u 20 – 30 ciklusa od kojih se svaki sastoji iz tri osnovne faze (Sl. 1):
– Zagrevanje reakcione smeše na 94 – 96 oC pri čemu dolazi do razdvajanja dvostrukih lanaca DNK matrice. Ova faza traje oko jedan minut.
– Hlađenje reakcione smeše na 40 – 60 oC pri čemu se vezuju prajmeri. Ova faza traje oko 30 sekundi u zavisnosti od dužine prajmera, jer je dužim prajmerima potrebno duže vreme za vezivanje.
– Zagrevanje reakcione smeše na 72 oC, pri čemu je Taq polimeraza započinje polimerizaciju i dostiže maksimum aktivnosti. Trajanje ove faze zavisi od dužine fragmenta koji se želi umnožiti i iznosi 1 – 2 minuta.
.
PCR bazirani testovi – opšta pravila i standardizacija metoda
Tržište hrane zahteva sve strožiju kontrolu. Namirnice su često pogrešno deklarisane u cilju sticanja ekonomske dobiti. Na taj način se kupci dovode u zabludu, što može imati negativan uticaj i na njihovo zdravlje, naročito kod osoba koje su osetljive na neke alergene. Tačna deklaracija je takođe važna pri izboru kupca za koju namirnicu će se odlučiti. Izbor može zavisiti i od načina života kupca, kao što je vegeterijanstvo, religija, itd.
Analitičke metode koje se koriste pri identifikaciji vrsta i provere ispravnosti hrane baziraju se uglavnom na mikrobiološkom ispitivanju, analizi proteina i DNK. Analiza proteina se vrši imunološkim, elektroforetskim i hromatografskim tehnikama. U poslednje vreme sve se više koriste DNK molekuli zbog veće stabilnosti od proteina, kao i zbog prisustva u najvećem broju tkiva. To ih čini veoma pogodnim za analizu hrane.
Lančana reakcija polimeraze – PCR (polimerase chain reaction) je postala nezaobilazna metoda u molekularnim istraživanjima. Lako se izvodi i obično zahteva manje vremena za postizanje rezultata od mikrobioloških metoda. Vreme potrebno da se istarživač bez predznanja osposobi za rad je oko nedelju dana, što je znatno kraće od mikrobioloških tehnika gde je potrebno veliko znanje i iskustvo. Proteklih godina reagensi za PCR su sve pristupačniji, lakši za upotrebu i dugotrajniji. Većina reagenasa, izuzev prajmera i proba, se mogu upotrebiti u više ponavljanja. Real-time PCR tehnika pored detekcije omogućuje kvantifikaciju produkta. I pored jos uvek skupe opreme za izvođenje PCR tehnike, ona postaje sve zastupljenija zbog prednosti u brzini, osetljivosti i specifičnosti u odnosu na mikrobiološke tehnike. Dok je za detekciju patogena u hrani mikrobiološkim tehnikama potrebno do 6 dana, PCR može dati rezultate za samo jedan dan. Međutim, PCR još uvek ne može imati dijagnostički status i još uvek je potrebno rezultate potvrditi mikrobiološki, ali procenjuje se da će već od 2010. godine ove dve tehnike imati isti status i obe biti validne za davanje konačnih rezultata.
.
Pripremanje laboratorije za izvođenje PCR baziranih testova
PCR je veoma osetljiva i jednostavna metoda koja može dati odgovore na mnoga genetička pitanja. Međutim, PCR može dati i lažne pozitivne ili negativne reakcije ukoliko se ne vodi računa o pravilnom postavljanju, standardizaciji i izvođenju metode. Zbog toga je neophodno napraviti standardizovane protokole za izvođenje PCR-a. Potrebno je voditi računa o opremanju i postavljanu laboratorije, proveriti ispravnost opreme i reagenasa, pravilno čuvati i odabirati reagense, ispravno birati sistem detekcije za PCR produkte i imati dobro obučeno osoblje.
.
Postavka PCR reakcije
Pri izboru mesta u laboratoriji za izvođenje PCR-a veoma je bitno voditi računa o izvorima kontaminacije. Idealno bi bilo koristiti četiri do pet različitih prostorija za različite faze PCR-a. Prva faza je priprema uzorka koja obuhvata pripremu reagenasa i izolaciju DNK. Zatim slede postavka PCR reakcije, tok reakcije (thermocycler) i detekcija PCR produkata. S obzirom da je veoma teško obezbediti ovoliko prostorija, fizička odvojenost se može postići postavljanjem opreme tako da se pri izvođenju metode osoblje i oprema kreću samo u jednom smeru. Ukoliko je moguće, proces bi trebao da se kreće u smeru iz čistijih i sterilnijih delova laboratorije, ka onima gde je veća mogućnost pojave zagadjenja u vidu aerosola. Osoblje reba uvek da nosi mantil i rukavice, čime se smanjuje mogućnost kontaminacije. Za svaku fazu PCR-a treba promeniti rukavice.
Priprema uzorka je najosetljivija faza PCR-a i najpodložnija kontaminaciji. Zbog toga bi trebalo imati tri odvojena mesta za:
- pripremu uzoraka
- pripremu reagenasa za DNK ekstrakciju
- ekstrakciju DNK iz uzorka
PCR može detektovati i svega nekoliko ćelija koje su kontaminirale negativan uzorak i dati lažno pozitivan rezultat. Da bi se to izbeglo neophodno je brisati spoljašnjost kivete dezinfekcionim sredstvom radi uklanjanja bakterija i DNK-aza (Borst, 2004). Mogućnost kontaminacije se smanjuje i ukoliko se supernatant usisava, umesto da se odliva. Upotreba UV lampe za dekontaminaciju mesta za izvođenje PCR-a može smanjiti opasnost od kontaminacije uzoraka. Samo mesto za detekciju produkata PCR-a, gde se kivete pipremaju za detekciju i premeštaju na agarozni gel, takođe može biti izvor kontaminacije uzorka. Da bi se sve to izbeglo mora se pažljivo rukovati sa uzorcima i voditi računa da se na svaki mogući način smanji mogućnost kontaminacije.
.
Oprema za PCR
Na prvom mestu se nalazi PCR aparat (termocycler) koji reguliše uslove za odvijanje same reakcije. Iako je to najskuplji deo opreme mora se imati u vidu i ostali potrebni pribor. Potrebno je nekoliko setova pipeta (najmanje četiri), oprema za elektroforezu, mikrotalasna rerna za topljenje agaroze, zamrzivač za čuvanje reagenasa (-20oC), UV svetlo za čitanje i fotoaparat za snimanje rezultata očitanih sa gela (Wellinghausen i sar 2004).
Pri odabiru PCR aparata portebno je uzeti u obzir nekoliko faktora. Cena aparata, nažalost, može biti jedan od presudnih faktora. Cena aparata zavisi od mogućnosti kojima raspolaže: kapacitet – 48 ili 96 uzoraka, da li se uzorci stavljaju u kivete ili mikroploču sa više jamica, ili koja je potrebna zapremina PCR reakcije. Vreme potrebno da se izvrši 30 ciklusa reakcije (10 ili 90 min), takođe utiče na izbor PCR aparata.
Svi instrumenti u PCR laboratoriji se moraju kalibrisati i obeležiti u skladu sa važećim institucionalnim standardima. Za većinu institucija kalibracija se vrši jednom godišnje.
.
Reagensi i prateći materijal
Reagensi za PCR se dele na one koji su potrebni za izvođenje same reakcije i one koji su potrebni za detektovanje proizvoda reakcije. Preporučuju se reagensi (prajmeri, probe i Taq polimeraza) samo od pouzdanih proizvođača. Treba koristiti najbolje proizvode i pri rukovanju njima uvek koristiti rukavice. Voda je veoma bitan sastojak PCR-a. Treba koristiti vodu oslobođenu od DNK i DNK-aza. Ona se dobija autoklaviranjem i filtriranjem (0,22µm). Ukoliko ima dovoljno novca može se kupiti fabrički proizvedena.
.
Kontrola kvaliteta
Prehrambene laboratorije izvode analize u skladu sa stadnardnom radnom procedurom. Njom je tačno definisano kako se izvode procedure i kako i kada vršiti kontrolu kvaliteta. Kontrola kvaliteta obuhvata testiranje svih reagenasa i produkata svakog seta za analizu, da bi se utvrdilo da ispunjavaju sve standarde kao i prethodni setovi i da su pogodni za upotrebu. Poželjno je, nakon kontrole kvaliteta, sve reagense razliti u bočice tako da se jedna bočica koristi za jednu analizu. Još je pogodnije odmah pripremiti smeše potrebne za PCR čime se smanjuje kontakt sa hemikalijama, a time i mogućnost greške. Kupovni setovi se prodaju sa prethodno testiranim reagensima, što treba da bude naznačeno na pakovanju. Standardna radna procedura mora da sadrži informacije o pozitivnim ili negativnim kontrolama. Osnovne PCR kontrole su: kontrola DNK ekstrakcije, uzorka uzetog iz organizma od interesa, drugog uzorka uzetog iz nesrodnog organizma, PCR kontrolu čiste poznate količine DNK iz organizma od interesa i kontrolu bez DNK. Za svaku laboratoriju je neophodno da vodi evidenciju o svemu što radi. Piše se laboratorijska sveska sa datumima i detaljima o protokolima, reagensima, kontrolama i rezultatima (Macrina 1995).
.
Nekomercionalni testovi za patogene u hrani
Laboratorija može odlučiti da komercijalni testovi ne zadovoljavaju njene potrebe i da želi da koristi nedavno objavljene prajmere ili čak da razvije sopstvene. Ukoliko se koriste podaci i metode drugih laboratorija mora se imati u vidu da se mogu javiti problemi usled različitih uslova i opreme u laboratorijama. Zbog toga se prethodno mora izvršiti provera metode koja treba da pokaže da je nova metoda jednaka ili bolja od do tada korišćene. Za komercijane metode to je već urađeno i naknadna provera nije potrebna. Pri odabiru PCR formata, veoma je bitno voditi računa i o tehničkim i kadrovskim mogućnostima laboratorije.
.
Potvrda ispravnosti metode i standardizacija
Pre nego što se nova metoda PCR-a prihvati za upotrebu, mora se izvršiti provera ispravnosti, specifičnosti, osetljivosti i ponovljivosti date metode. Da bi rešila ovaj problem Evropska komisija je pokrenula projekat pod nazivom FOOD-PCR sa ciljem da se izvrši provera i standardizacija PCR metoda za detekciju bakterijskih patogena u hrani. Projekat je krenuo u martu 2000. godine i trajao do juna 2003. godine. Napravljen je konzorcijum od 35 instituta, kompanija i univerziteta iz 21 zemlje da radi na ovom projektu. Projekat je bio usmeren ka razvoju metoda za detekciju pet najvažnijih patogena: Salmonella enterica, termofilna Campylobacter spp., Eschericia coli, Listeria monocztogenes i Yersinia enterocolitica.
Razvoj standardizovanih metoda se odvijao u tri faze. U prvoj fazi su birani definisani DNK uzorci i metode PCR-a koje bi mogle biti pogodne za upotrebu. Projekat je takođe obuhvatao i pripremu uzoraka. U drugoj i trećoj fazi je vršena provera efikasnosti i upotrebljivosti odabranih PCR metoda. Vršene su kompletne provere procedure pripreme uzoraka i PCR metode da bi se dobili verifikovani PCR protokoli za otkrivanje patogena u hrani. Pored toga cilj projekta je bio i da se obezbede biohemijski setovi za testiranje različitih tipova PCR aparata i izolaciju DNK iz bakterijskih kultura, proizvodnja odgovarajućih DNK prajmera, internet bazu podataka sa PCR protokolima, organizovanje obuke i pravljenje standardizovanih uputstava u saradnji sa Evropskim komitetom za standardizaciju (Anon, 1999A, Anon, 2000).
Priprema internacionalnih standarda može biti dugačak i glomazan posao i može trajati do nekoliko godina. Posebno su dugačke standardizacije metoda za otkrivanje genetički modifikovanih organizama.
Pri opisivanju i proveravanju metode mora se voditi računa o izrazima koji se upotrebljavaju. Poseban problem predstavlja izraz osetljivost koji se u PCR laboratorijama, pored praga detekcije, može odnositi i na uticaj inhibitora prisutnih u uzorku na polimerazu. Na osnovu međunarodno priznatih protokola i uputstava predložene su definicije koje bi trebalo da budu opšte prihvaćene (Tab. 1 i Tab. 2) (Anon1999).
Već je spomenuto da razvoj i verifikacija metoda za detekciju patogena zasnovanih na PCR-u treba da se odvija u tri faze. Razvoj i testiranje prajmera je prva faza u uspostavljanju standardne PCR (Tab. 3). Laboratorije koje imaju iskustvo sa prajmerima i datim patogenom predlažu koje prajmere bi trebalo koristiti. Laboratorije zatim prave spisak ćelijskih linija patogena koji se ispituje. Iz svake linije se ekstrahuje DNK i analizira sa serijom PCR-ova koji sadrže ispitivane prajmere. Svaka PCR treba da sadrži što uniformnije reagense i kalibrisane termociklere. PCR zatim treba da bude optimiziran i uspostavljen prag detekcije (broj ćelija koje će detektovati sa verovatnoćom od 99 %).
Druga faza obuhvata veliki broj interlaboratorijskih testova koji treba da potvrde specifičnost PCR-a. Na tom poslu bi trebalo da bude uključeno 10 – 12 partnerskih laboratorija (Anon, 1999). Svaka laboratorija dobija standardnu proceduru, uzorke DNK iz ćelijskih linija, i reagense. DNK uzorci treba da budu obeleženi kodovima tako da njihov identitet zna samo vodeća laboratorija. Potrebno je izračunati odnos pravih i lažnih pozitiva i pravih i lažnih negativa (Tab 2). Kod preciznih i tačnih PCR-ova, u oba slučaja odnos je 100 %.
Tabela 1 : Predložene definicije izraza (Anon1999)
| Potvrda validnosti | Dokazivanje da određena PCR metoda daje podudarne rezultate u poređenju sa referentnim metodom |
| Kvalitativna PCR | Test koji potvrđuje prisustvo ili odsustvo PCR produkata. Rezultati se detektuju vizuelno ili opremom |
| Kvantitativna PCR | Test kojim se određuje broj umnožaka koji se detektuju indirektno i povezani su sa brojem ciljnih organizama |
| Prag detekcije (PD) | Najmanji broj ciljnih organizama koji je potreban da se dobije pozitivan PCR odgovor |
| Selektivnost | Mera umnožavanja ciljnih molekula (u smeši više različitih) i isključenja (manjak umnožaka poreklom iz blisko srodnih vrsta) |
| Pozitivna greška (PG) | Pozitivna reakcija za koji referentni metod daje negativnu reakciju (lažni pozitiv) |
| Negativna greška (NG) | Negativna reakcija za koji referentni metod daje pozitivnu reakciju (lažni negativ) |
| Pozitivno poklapanje (PP) | Slučaj kada i PCR i referentni metod daju pozitivnu reakciju |
| Negativno poklapanje (NP) | Slučaj kada i PCR i referentni metod daju negativnu reakciju |
| Preciznost dijagnostifikovanja (PD) | Stepen poklapanja rezultata dobijenih PCR-om i referentnim metodom prilikom upotrebe istih uzoraka ( PD = (PP + NP) / ukupan broj uzoraka) |
| Osetljivost | Sposobnost PCR-a da detektuje organizam tamo gde ga je detektovao i referentni metod (PP / N+) x 100 |
| Specifičnost | Sposobnost PCR-a da ne detektuje organizam tamo gde ga nije detektovao ni referentni metod (NP / N–) x 100 |
| Robustnost | Ponovljivost od strane drugih laboratorija u kojima se koriste reagensi i aparatura od drugih proizvođača |
N+ je ukupan broj pozitivnih reakcija dobijenih referentnim metodom
N– je ukupan broj negativnih reakcija dobijenih referentnim metodom
Tabela 2: Primeri rezultata dobijenih referentnim i PCR metodom
| PCR odgovor | Referentni metod pozitivan (R+) | Referentni metod negativan (R-) |
| PCR + | +/+ pozitivno poklapanje (PP) | –/+ pozitivna greška (PG) |
| PCR – | +/– negativna greška (NG) | –/– negativno poklapanje (NP) |
PCR treba da bude robustna, odnosno da se može izvoditi sa reagensima različitih proizvođača. Ovo je najpovoljnije proveriti tokom probnih testova druge faze. Robustnost se proverava ponavljanjem provere specifičnosti, ali sa upotrebom reagenasa i enzima od različitih proizvođača.
Treća i poslednja faza uključuje proveru validnosti kompletne metode u poređenju sa standardnom metodom. To se takođe postiže interlaboratorijskim testovima koji uključuju 10-12 partnera. Laboratojijama se šalju uzorci sa različitim brojem prisutnih ćelija. Po Nordvalovom uputstvu trebalo bi imati nula, 1-10 i 10-100 ćelija/25 g uzorka (Anon, 2001). Uzorci se zatim inkubiraju i beleže rezultati. Istovremeno se uzorci ispituju i konvencionalnom metodom. Vodeća laboratorija poredi rezultate dobijene svakim metodom. Rezultati najmanje osam laboratorija moraju biti obrađeni da bi bili potpuni (Anon, 1999). Specifičnost, osetljivost i preciznost uopšte, svake metode trebaju da budu utvrđeni i upoređeni. Robustnost i efikasnost metoda koje se zasnivaju na PCR-u treba da budu barem na nivou standardnih metoda.
Tabela 3: Faze razvoja metode zasnovane na PCR-u
| Faza 1: -Procena nekoliko PCR prajmera za svaki patogen -Odabir jednog seta -Prilagođavanje za PCR Definisanje detekcionog limita |
| Faza 2: Provera preciznosti i robustnosti PCR-ova a – partneri koriste standardne reagense b – partneri koriste reagense po izboru -Pripremaju se ćelijske linije svakog patogena -Izolovanje DNK iz svake linije -Procena specifičnosti PCR od strane 10 – 12 laboratorija |
| Faza 3: Provera kompletne metode zasnovane na PCR-u -Korišćenje uzoraka sa velikim, srednjim i malim brojem, kao i bez ćelija -10 – 12 učesnika -Laboratorije vrše inkubaciju, ekstrakciju i PCR detekciju u skladu sa standardnom procedurom izvođenja -Uzorci se testiraju postojećim standardnim metodama -Poređenje rezultata dobijenih PCR i standardnom metodom |
Prezentovane činjenice vezane za dobru laboratorijsku praksu u opremanju PCR laboratorije i standardizaciju testova su vezane za mikrobiološku laboratoriju (Sanchez, 2006), ali se mogu primeniti u svim laboratorijama koje ispituju kvalitet prehrambenih proizvoda.
.
Literatura
1. Anon. (1999): Microbiology of food and feeding stuffs— Protocol for the validation of alternative methods. Document established by the Joint Group of MicroVal (WG 6) and CEN (WG 6/TAG 2). ISO/DIS 16140, Geneva, Switzerland.
2. Anon. (1999A): Microbiology of food and animal feeding stuff—carcass sampling for microbiological analysis. ISO/CD 17604. International Organization for Standardization, Geneva, Switzerland.
3. Anon. (2000): Microbiology of food and animal feeding stuff—Preparation of test samples, initial suspension and decimal dilution for microbiological examination. Doc CEN/TC 275/ WG 6 N 114. Published by AFNORE, Paris, France.
4. Anon. (2001): Protocol for the validation of alternative microbiological methods. NV-DOC.D-2001-04-25. Published by NordVal. Copenhagen, Denmark.
5. Arlorio, M., Coïsson, J. D., Cereti, E., Travaglia, F., Capasso, M., Martelli, A. (2003): Eur Food Res Technol 216: 253–258.
6. Asensio, L., González, I., Fernández, A., Céspedes, A., Hernández, P. E., García, T., Martín, R. (2000): J Food Prot 63: 1248–1252.
7. Asensio, L., González, I., Fernández, A., Rodríguez, M. A., Hernández, P. E., García, T., Martín, R. (2001): J Agric Food Chem 49: 1720–1723.
8. Asensio, L., González, I., Fernández, A., Rodríguez, M. A., Lobo, E., Hernández, P. E., García, T., Martín, R. (2001): Arch Lebensmittelhyg 52: 131–134.
9. Asensio, L., González, I., Fernández, A., Rodríguez, M. A., Lobo, E., Hernández, P. E., García, T., Martín, R. (2002): J Food Prot 65: 432–435.
10. Bania J, Ugorski M, Polanowski A, Adamczyk E (2001) J Dairy Res 68:333–336
11. Borst, A., Box, A. T., Fluit A. C. (2004): False-positive results and contamination in nucleic-acid amplification assays: Suggestions for a “prevent and destroy“ strategy. Eur. J. Clin. Microbiol. Infect. Dis. 23: 289-299.
12. Brezná, B., Hudecová, L., Kuchta, T. (2006): Eur Food Res Technol 223: 373–377.
13. Busconi, M., Foroni, C., Corradi, M., Bongiorni, C., Cattapan, F., Fogher, C. (2003): Food Chem 83: 127–134.
14. Céspedes, A., García, T., Carrera, E., González, I., Hernández, P. E., Martín, R. (1999): J Agric Food Chem 47: 1046–1050.
15. Doveri, S., O’Sullivan, D. M., Lee, D. (2006): J Agric Food Chem 54: 9221–9226.
16. Hernández, M., Rodríguez-Lazaro, D., Zhang, D., Esteve, T., Pla, M., Prat, S. (2005): J Agric Food Chem 53: 3333–3337.
17. Holst-Jensen, A., Rønning, S. B., Løvseth, A., Berdal, K. G. (2003): Anal Bioanal Chem 375: 985–993.
18. Holzhauser, T., Wangorsch, A., Vieths, S. (2000): Eur Food Res Technol 211: 360–365.
19. Köppel, E., Stadler, M., Lüthy, J., Hübner, P. (1998): Z Lebensm Unters Forsch A 206: 399–403.
20. Leimanis, S., Hernández, M., Fernández, S., Boyer, F., Burns, M., Bruderer, S., Glouden, T., Harris, N., Kaeppeli, O., Philipp, P., Pla, M., Puigdomènech, P., Vaitilingom, M., Bertheau, Y., Remacle, J. (2006): Plant Mol Biol 61: 123–139.
21. López-Calleja, I., Alonso, I. G., Fajardo, V., Rodríguez, M. A., Hernández, P. E., García, T., Martín, R. (2005): Int Dairy J 15: 1122–1129.
22. López-Calleja, I., González, I., Fajardo, V., Martín, I., Hernández, P. E., García, T., Martín, R. (2005): J Dairy Sci 88: 3115–3120.
23. López-Calleja, I., González, I., Fajardo, V., Martín, I., Hernández, P. E., García, T., Martín, R. (2007): Int Dairy J 17: 729–736.
24. Lopparelli, R. M., Cardazzo, B., Balzan, S., Giaccone, V., Novelli, E. (2007): J Agric Food Chem 55: 3429–3434.
25. Macrina, F.L. (1995): Scientific Integrity: An Introductory Text with Ceses. ASM Press, Washington, DC.
26. Mafra, I., Ferreira, I. M. P. L. V. O., Beatriz, M., Oliveira, P.P. (2007): Food authentication by PCR-based methods. Universidado de Porto, Porto.
27. Mafra, I., Ferreira, I. M. P. L. V. O., Faria, M. A., Oliveira, B. P. P. (2004): J Agric Food Chem 52: 4943–4947.
28. Matsunaga, T., Chikuni, K., Tanabe, R., Muroya, S., Shibata, K., Yamada, J., Shinmura, Y. (1999): Meat Sci 51: 143–148.
29. Maudet, C., Taberlet, P. (2001): J Dairy Res 68: 229–235.
30. Meyer, R., Höfelein, C., Lüthy, J., Candrian, U. (1995): J AOAC Int 78:1542–1551.
31. Montiel-Sosa, J. F., Ruiz-Pesini, E., Montoya, J., Roncalés, P., López-Pérez, M. J., Pérez-Martos, A. (2000): J Agric Food Chem 48:2829–2832.
32. Pasqualone, A., Montemurro, C., Grinn-Gofron, A., Sonnante, G., Blanco, A. (2007): J Agric Food Chem 55: 3312–3318.
33. Regulation (EC) No 1829/2003 of the European Parliament and of the Council of 22 September 2003 on genetically modiWed food and feed. OV J Eur Union L 268:1–23
34. Regulation (EC) No 1830/2003 of the European Parliament and of the Council of 22 September 2003 concerning the traceability of food and feed products produced from genetically modiWed organisms and amending Directive 2001/18/EC. OV J Eur Union L 268:24–28
35. Russel, V. J., Pryde, S. E., Santos, A. T., Rosa, C., Quinteiro, J., Rey-Méndez, M. (2002): Eur Food Res Technol 214: 171–177.
36. Rønning, S. B., Rudi, K., Berdal, K. G., Holst-Jensen, A. (2005): J Agric Food Chem 53: 8874–8880.
37. Sanchez, S. (2006): Making PCR a normal routine of the food microbiology lab. The University of Georgia, Athens.
38. Stephan, O., Vieths, S. (2004): J Agric Food Chem 52: 3754–3760.
39. Wellinghausen. N., Wirths, B., Essig, A., Wassill, L. (2004): Evaluation of the Hyplex Bloodscreen multiplex PCR-enzyme-linked immunosorbent assay system for direct identification of gram-positive cocci and gram-negative bacilli from positive blood cultures. J. Clin.Microbiol. 43: 3147-3152.
40. Wolf, C., Lüthy, J. (2001): Meat Sci 57: 161–168.
41. Wolf, C., Rentsch, J. (1999): J Agric Food Chem 47: 1350–1355.
42.http://www.greenfacts.org/
43.http://www.celiac.org/
44.http://www.bio.davidson.edu/