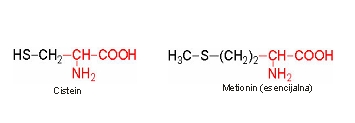Prof. Dr Midhat Jašić
Tehnološki fakultet, Tuzla
Tel.: +387 61 721060; +387 35 320745
E-mail: jasic_midhat@yahoo.com
E-mail: midhat.jasic@untz.ba
.
.
Tvari s azotom se nalaze u hrani u različitim kombinacijama. Mogu biti sastavni dio različitih spojeva:
• aminokiselina, peptida i proteina,
• amidnih spojeva,
• amina i nitrita i drugih.
U hrani se mogu naći slobodne aminokiseline, kratkolančani peptidi, aminošećeri, kreatin, kreatinin, urea, mokraćna kiselina, amonijak kao i različite vrste alkaloida. Aminokiseline u hrani rijetko dolaze u slobodnom stanju. Mogu se industrijski proizvesti hidrolizom iz proteina. Kratkolančani peptidi su takođe vrlo rijetki u hrani. Kreatin , kreatinin i nukleotidi mogu se naći slobodni u malim količinama samo u mlijeku, dok amina i nitrita ima u nekim vrstama zelenog povrća. Alkaloidi suspojevi koji sadrže azot i čest su sastojak začinskog povrća, aromatičnog i ljekovitog bilja.
Sa prehrambenog aspekta u pogledu zastupljenosti u hrani, najznačajniji predstavnik tvari sa azotom je protein. Naziv protein potiče od grčke riječi proteos, što znači prvi ili najvažniji. Proteini su kompleksni organski spojevi, visoke molekularne težine koji se sastoje od aminokiselina povezanih peptidnom vezom. To su najsloženije organske materije veoma velike molekularne mase. Mogu biti rastvorljivi ili nerastvorljivi u vodi. U građi molekula proteina su zastupljeni kiseonik, vodonik, ugljenik i azot, a u nekim i sumpor ili fosfor. Ovi elementi ulaze u sastav aminokiselina. Aminokiselinski sastav različitih proteina nije isti i predstavlja najvažniju karakteristiku svakog proteina, a služi i kao kriterijum vrijednosti proteina u prehrani. Broj aminokiselina koje ulaze u sastav proteina je 20. One svojim različitim kombinovanjem obrazuju izvanredno veliki broj različitih proteina.
.
Aminokiseline
U strukturi proteina učestvuje dvadeset različitih aminokiselina. Prva otkrivena aminokiselina je asparagin (1806.), dok je zadnja treonin koji je otkriven 1938. godine. Neke aminokiseline čovjekov organizam može sam da sintetizira, dok neke ne može. Esencijalne (nezamjenjive) aminokiseline mogu se unositi u organizam isključivo kroz hranu, dok se neesencijalne mogu sintetizirati u organizmu iz drugih matabolita. Proteini se u probavnom traktu razgrađuju do aminokiselina da bi se ponovno u organizmu iz njih sintetizirali.
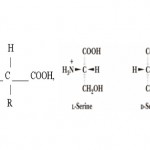
Aminokiseline sadrže amino (-NH2) i karboksilnu (-COOH) grupu i zato se tako i zovu. Aminokiseline sadrže karboksilnu grupu i zato su „kiseline“ u nazivu. Karboksilna grupa (-COOH) i amino grupa je vezana na alfa (prvi) ugljikov atom. Sve aminokiseline u našem organizmu su iz skupine alfa, što znači da imaju azot na prvom (alfa) ugljikovom atomu u molekuli.
Amino i karboksilna grupa spojene na alfa ugljikov atom daju molekuli asimetričnost koja zakreće polariziranu svjetlost. Naše tijelo može iskoristiti samo aminokiseline koje zakreću svjetlost u lijevo. Takve aminokiseline se prepoznaju po dodanom slovu L ispred njihova imena. Izuzetak su taurin , GABA i glicin koji nisu ni „L“ ni „D“ tip i fenilalanina koji se može iskoristiti u „L“ i „D“ formi. Aminokiselinski ostaci u proteinima su L-stereoizomeri. D-aminokiselinski ostaci su nađeni smo u nekoliko malih peptida (peptidi ćelijskog zida bakterija i neki peptidni antibiotici).
Aminokiseline se dijele na 5 klasa na osnovu polarnosti R-grupa odnosno njihove tendencije da reaguju s vodom:
- nepolarne alifatske R grupe
- aromatske R-grupe
- polarne nenaelektrisane R-grupe
- pozitivno naelektrisane (bazne) R-grupe
- negativno naelektrisane (kisele) R-grupe
Rje aminokiselinski ogranak (radikal). Kod glicina je to H atom. Aminokiselinama se mogu dati sistemska imena kao npr. α-aminooctena kiselina. Međutim, uobičajeno je da se upotrebljavaju trivijalna imena koja su jednostavnija.
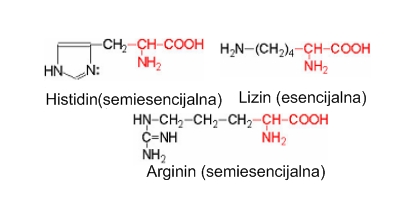
Naelektrisani ostaci aminokiselina su jako hidrofilni, i obično se nalaze sa spoljne strane proteina. Pozitivno naelektrisani bočni lanci su prisutni u lizinu i u argininu, a u nekim slučajevima i histidinu. Negativna naelektrisanja se nalaze u glutaminskoj i asparaginskoj kiselini.
Tabela 3.2.1. Osobine aminokiselina u sastavu proteina
| Aminokiselina | Skraćenica | Mr | pI | Zastupljenost u proteinima (%) |
| Nepolarne alifatske R grupe | ||||
| Glicin | Gly | 75 | 5.97 | 7.2 |
| Alanin | Ala | 89 | 6.01 | 7.8 |
| Prolin | Pro | 115 | 6.48 | 5.2 |
| Valin | Val | 117 | 5.97 | 6.6 |
| Leucin | Leu | 131 | 5.98 | 9.1 |
| Izoleucin | Ile | 131 | 6.02 | 5.3 |
| Metionin | Met | 149 | 5.74 | 2.3 |
| Aromatske R grupe | ||||
| Fenilalanin | Phe | 165 | 5.48 | 3.9 |
| Tirozin | Tyr | 181 | 5.66 | 3.2 |
| Triptofan | Trp | 204 | 5.89 | 1.4 |
| Polarne nenaelektrisane R grupe | ||||
| Serin | Ser | 105 | 5.68 | 6.8 |
| Treonin | Thr | 119 | 5.87 | 5.9 |
| Cistein | Cys | 121 | 5.07 | 1.9 |
| Asparagin | Asn | 132 | 5.41 | 4.3 |
| Glutamin | Gln | 146 | 5.65 | 4.2 |
| Pozitivno naelektrisane R grupe | ||||
| Lizin | Lys | 146 | 9.74 | 5.9 |
| Histidin | His | 155 | 7.59 | 2.3 |
| Arginin | Arg | 174 | 10.76 | 5.1 |
| Negativno naelektrisane R grupe | ||||
| Aspartat | Asp | 133 | 2.77 | 5.3 |
| Glutamat | Glu | 147 | 3.22 | 6.3 |
Bočni lanac utiče na hemijske osobine aminokiselina i može biti jedan od 20 različitih bočnih lanaca, kod proteinogenih aminokiselina. Reaktivnost aminokiselina zasnovana je na prisustvu karboksilne, amino i hidroksilne skupine u njenom sastavu. Esteri aminokiseline nastaju ako organska grupa zamjenjuje jedan ili više atoma vodika u hidroksilnoj skupini aminokiseline, dok amidi nastaju kad se u karboksilnoj grupi aminokiseline, hidroksilna grupa zamjeni amino-grupom – NH2.
Tabela br 3.2.2. Reaktivnost aminokiselina i neki tipični produkti
| Skupine | Formula | Produkti |
| Karboksilne | -COOH | estri, amidi |
| Amino | -NH2 | amidi i Schiffove baze |
| Hidroksilne | R-OH | estri |
Aminokiseline su najvećim djelom kristalne čvrste tvari visokih tališta (od 186°C za glutamin, do 344°C za tirozin), topljive u vodi, a netopljive u nepolarnim organskim otapalima. Amfoterni su spojevi – to znači da se mogu ponašati kao kiseline i kao baze, ovisno o pH medija u kojoj se nalaze.
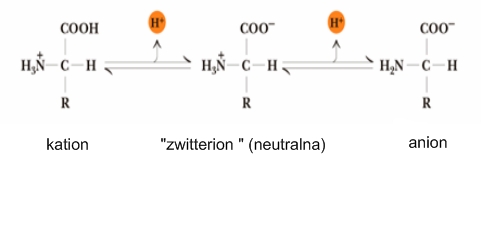
Visoka tališta i topljivost u vodi posljedica su amfoternosti aminokiselina. To je zbog toga što imaju svojstva kiselina i baza, jer u istoj molekuli imaju karboksilnu i amino – skupinu. Karboksilna skupina otpušta proton (H), a amino skupina ga prima, pa aminokiselina u čvrstom stanju iz molekulskog oblika prelazi u dipolni ion – „zwitterion“. Aminokiseline otopljene u vodi mogu djelovati kao donori ili kao akceptori protona, tj. mogu neutralizirati i baze i kiseline. Zbog toga se često ponašaju kao puferi . Ka je konstanta disocijacije kiseline. Ako je Ka =10 -6 onda je pKa= 6 kao što je slučaj sa histidinom.
Vrijednost pH kod kojeg u otopini prevladava dipolarni ion (izoelektrična tačka ) je aritmetička sredina vrijednosti pK karboksilne i amino – skupine. Izoelektrična tačka je pH pri kojem je neto naboj aminokiseline, peptida ili proteina jednak nuli. U jako kiseloj otopini aminokiselina je prisutna kao kation, kod pH izoelektrične tačke prevladava dipolarni ion, a u jako lužnatoj otopini aminokiselina postaje anion.
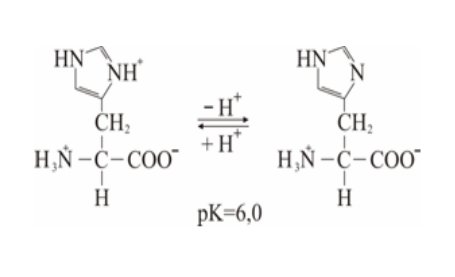
Vrijednosti pK za α – COOH (pK1 karboksilnih skupina) kreću se u uskom području od 1,7 do 2,6 – u prosjeku 2,2, dok se za α – NH3+, pK vrijednosti kreću od 8,9 do 10,6 – u prosjeku 9,5. Tu su još i funkcionalne skupine pobočnih lanaca aminokiselina. Na primjer, pK za –SH skupinu cisteina iznosi 8,3 a za imidazolski prsten histidina 6,0.
Tabela 3.2.3. Kisele i bazične aminokiseline
| Naziv | Oznaka |
| α-karboksilna skupina | (-COOH): |
| α-amino skupina | (-NH3+): |
| Kisele aminokisline | |
| Aspartat, | Asp, |
| Glutamat | Glu, |
| Bazične | |
| Arginin, | Arg, |
| Histidin, | His |
| Lizin, | Lys, |
Tabela 3.2.4. Aminokiselinski ogranci i njihove karakteristične skupine
| Aminokiselinski ogranci | Karakteristične skupine | Aminokiseline koje ih sadrže |
| Alifatski | alifatski spojevi | alanin, valin, leucin, izoleucin |
| Alifatska hidroksilna skupina | alifatski spoj + hidroksilna skupina | serin i treonin |
| Aromatske skupine | benzolovo jezgro | fenilalanin, tirozin, triptofan |
| Bazne skupine | -OH | lizin, arginin, histidin |
| Kiseli ogranci | -COOH | aspartat i glutamat |
| Amidni ogranci | karbonilna grupa sa N | asparagin i glutamin |
| Ogranci sa sumporom | -S | cistin i metionin |
| Imino skupina | =NH | prolin |
.
Ključni pojmovi
- Hemijska svojstva aminokiselina ovise o njihovoj hemijskoj strukturi, a naročito o strukturi radikala R.
- Aminokiselinski ogranci mogu biti: alifatski, alifatski sa hidroksilnom skupinom, sa aromatskim skupinama, baznim skupinama, kiseli, amidni, ogranci sa sumporom i sa imino skupinom.
- Reaktivnost aminokiselina zasnovana je na prisustvu karboksilne, amino kao i R skupine.
- Aminokiseline su amfoterni su spojevi.
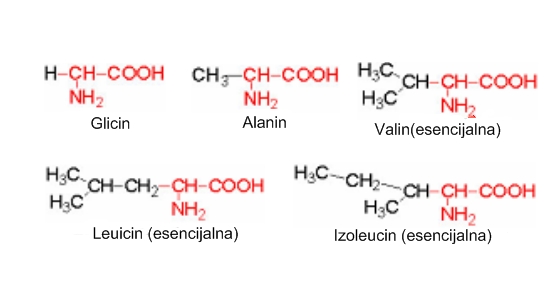
Aminokiseline sa alifatskom R-grupom. Glicin je najednostavnija aminokiselina i jedina koja nema asimetrični C atom. Bočni lanac kod glicina sastoji se od samo jednog vodikovog atoma. Glicinski ostatak ima vrlo malen volumen, što je važno za izgradnju određenih struktura kao što je kolagen. Alanin, valin, leucin i izoleucin imaju ugljikovodične bočne lance koji se sastoje od najviše četiri ugljikova atoma. Alanin se može smatrati kao ishodni spoj za sve druge aminokiseline jer zamjenom jednog ili oba vodika u metilnoj grupi, nekim drugim ostatkom, nastaju strukturne formule ostalih aminokiselina.
Valin leucin i izoleucin , imaju razgranat ugljikov skelet. Hemijski su razmjerno slični, pogotovo leucin i izoleucin.
Glicin je antacid i zaslađivač. Sudjeluje u sintezi DNA, fosfolipida i kolagena. Pomaže skladištenju glukoze putem povećanja mogućnosti skladištenja glikogena. Alanin je jedna od najčešćih aminokiselina u sastavu proteina. Osim uobičajenih gradivnih funkcija, služi i za proizvodnju energije i pomaže u regulaciji šećera u krvi.
Aminokiseline razgranatog lanca BCAA su: leucin, izoleucin i valin. Mišićno je tkivo satkano od BCAA koje mu služe za proizvodnju energije i sintezu proteina.
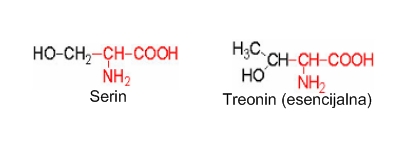
Aminokiseline sa hidroksil R-grupom. Serin, treonin i tirozin imaju hidroksilnu grupu u pobočnim lancima. Serin sadrži jednu alkoholnu hidroksilnu skupinu koja može ući u reakcije kao što su reakcija stvaranje estera. Ester s fosfatnom kiselinom fiziološki je važan sastavni dio nekih proteina i fosfatida. Hidroksilna skupina ima posebnu funkciju u nekim enzimima. Treonin je slijedeći viši homolog serina. Posjeduje dva asimetrična C atoma pa može postojati u četiri stereoizomerna oblika.
Treonin je važan za razvoj i stabilnu funkciju tiroidne žlijezde i imunološkog sistema. U kombinaciji s asparaginskom kiselinom i metioninom pomaže funkciju jetre.
Amino kiseline sa R koji sadrži sumpor. Cistein sadrži sumpor čija je sulfhidridna skupina prilično reaktivna. Cistein unutar peptida može lagano dehidrogenirati pri čemu nastaje disulfid. To povezivanje preko S-S veze nalazi se kod mnogih proteina. Metionin je esencijalna aminokiselina odnosno S–metil derivat homocisteina. Metilna grupa može se u metabolizmu prenijeti na druge molekule, i zato je metionin glavni donor –CH3 grupa.
Cistein je važan za sintezu keratina, proteina koji se nalazi u koži, kosi i noktima. Ima važnu ulogu u energetskom metabolizmu i sintezi masnih kiselina. Metabolit aminokiseline cisteina u organizmu je homocistein, čija količina u organizmu može biti pokazatelj rizika za bolesti i oštećenja kardiovaskularnog sistema ili bubrega. Na regulaciju homocisteina i snižavanje njegove koncentracije mogu utjecati vitamini B skupine, folna kiselina, vitamin B12, vitamin B6. Povišena koncentracija homocisteina se javlja kao jedan od faktora tzv. metaboličkog sindroma.
Metionin učestvuje u sintezi taurina, cisteina, lecitina, karnitina i endorfina. Važan je za zdrave nokte i kožu.
Derivat metionina i cisteina je aminokiselina taurin koja takođe sadrži sumpor. To je najzastupljenija slobodna aminokiselina u mišićnom tkivu, a nalazi se i u živcima. Sudjeluje u sintezi žučnih soli, u brojnim drugim metaboličkim procesima, a važna je za očuvanje očne retine.
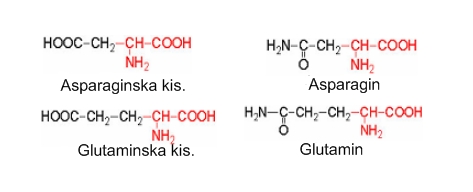
Amidne aminokiseline. Asparagin i glutamin su amidi “kiselih aminokiselina“ koji imaju polarne amidne grupe (O=C-NH2). Pri hidrolizi proteina s kiselinom ili lužinom otcjepljuju se amidne grupe i pri tom nastaje amonijak i asparaginska, odnosno glutaminska kiselina. Ove kiseline na pobočnom lancu imaju još jednu kiselu skupinu kojoj se proton lagano odcjepljuje disocijacijom. Zbog toga nastaju dodatni negativni naboji (važno za elektrokemijska svojstva proteina).
Asparaginska kiselina se nalazi u aspartamu umjetnom sladilu. Odgovorna za pretvaranje amonijaka u ureu i uključena je u konverziju ugljikohidrata u mišićnu energiju. Gradivni je element imunog sistema – imunoglobulina i antitijela. Važna je kod regeneracije tkiva. Aspartat nastaje kada se kation veže na asparaginsku kiselinu.
Asparagin se nalazi u brojnim vrstama žitarica i krompira i to u relativno velikim količinama. Učestvuje u Maillardovim reakcijama tokom prženja hrane proizvodeći štetni akrilamid. Važan je faktor u metaboličkim procesima živčanog sistema.
Glutaminska kiselina je najzastupljenija u pšenici. Uključena je u metabolizam šećera i masti. Ima važnu ulogu za funkcioniranje mozga, sintezi DNA, glutationa i ostalih aminokiselina. Pomaže odstranjenju amonijaka iz tijela.
Glutamin je izvor energije za mozak i cijelo tijelo. U određenim stanjima u organizmu glutamin može postati deficitaran kao kod opeklina, upalnih bolesti crijeva i sl. Koncentracija glutamina u krvi je tri do četiri puta veća od svih ostalih aminokiselina. U organizmu se prevodi u glutaminsku kiselinu. Također je glutamin bitan za rad tankog i debelog crijeva, gdje predstavlja važno gorivo za stanice crijevnog epitela. Važan je sastojak u antioksidativnom sustavu glutationa, i kao takav jedan od ključnih nutrijenata za dobru funkciju imuno sustava.
Bazne skupine aminokiselina. Lizin, arginin i histidin imaju po 6 C atoma. Bazne grupe u pobočnim lancima tih aminokiselina odgovorne su za pozitivne naboje na proteinima. Arginin ima najjača bazična svojstva, a zatim slijedi lizin. U mnogim aktivnim centrima enzima nalazi se reaktivna NH2 skupina lizina. Histidin sadrži slabo bazični imidazolski prsten. Kako pH vrijednost imidazola leži blizu neutralne vrijednosti, histidin može kod enzimske katalize djelovati kao donor ili akceptor protona. Zbog toga se u mnogim aktivnim centrima enzima nalaze histidinski ostaci.
Arginin je esencijalna aminokiselina za mišićni metabolizam i iskorištavanje azota. Važna je komponenta za izgradnju i regeneraciju tkiva. U visokoj koncentraciji se nalazi u koži i vezivnom tkivu, te pomaže odstranjivanju amonijaka kao dijela ciklusa uree. Derivat arginina je aminokiselina ornitin s kojom je u povratnoj vezi. Ornitin takođe sudjeluje u ciklusu uree, koji je vrlo važan metabolički put za regulaciju azota u organizmu. Lizin je važan je za rast, regeneraciju tkiva i proizvodnju hormona, enzima i antitijela. Ima ga u mišićnom tkivu.
Histidin se u organizam unosi uglavnom prehranom iako i djeca i odrasli mogu sintetizirati nešto malo histidina u tijelu. Stanice otpuštaju histidin pri imunološkoj reakciji. Značajan je za rast i regeneraciju tkiva.
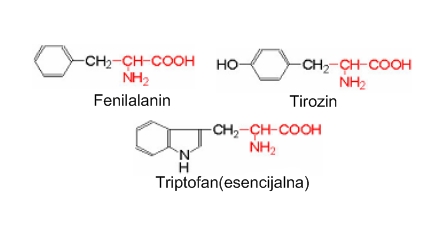
Aminokiseline sa aromatskim prstenom. Fenilalanin sadrži jedan aromatski prsten, pa se stoga ne može sintetizirati u ljudskom organizmu. Tirozin posjeduje fenolnu grupu koja ima slabo kisela svojstva te iznad pH 9 disocira proton. Triptofan je heterocikločka α – aminokiselina koja posjeduje indolski prsten.
Fenilalanin posjeduje jedinstvenu ulogu blokatora nekih enzima središnjeg živčanog sistema koji su uobičajeno zaduženi za raspad prirodnih, morfiju sličnih, hormona zvanih endorfini i enkefalini.
Tirozin je sastavni dio proteinskih amino šećera i amino lipida, koji imaju višestruke funkcije. Prekursor je za neurotransmitere – dopamin, adrenalin i noradrenalin.
Važan je dio nekih peptida, kao što su enkefalini koji su prirodni opijati-moždani analgetici. Prekursor je hormonima poput tiroksina, kateholestrogena (spojeva koji su ujedno estrogeni i katehoalamini) i najvažnijeg hormona za pigmentaciju – melanina. Triptofan je esencijalna aminokiselina i u metabolizmu sudjeluje kao gradivni dio proteina. Važan je aminokiselinski prekursor neurotransmitera serotonina i melatonina.
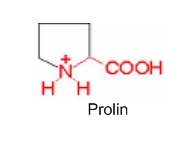
Iminokiseline. Prolin je cikličke građe. Azotov atom u α položaju uključen je u prsten, pa stoga nije primaran, već sekundaran amin. Ako je prolin povezan u peptidu može se hidroksilacijom modificirati u hidroksiprolin, što je bitno u sintezi kolagena. Prolin ima bočni lanac vezan na azot amino grupe a i na α – C – atom, formirajući tako cikličku strukturu. Aminokiseline mogu i ne moraju biti topljive u vodi što ovisi o slobodnom radikalu (R). Sve osim glicina su optički aktivni spojevi što znači da mogu zakretati ravninu polarizirane svjetlosti i sadrže bar jedan asimetričan C-atom (L i D izomeri).
Prolin je nužan za sintezu kolagena i i oporavak hrskavice.
Tabela 3.2.5. Aminokiseline – preteče brojnih biološki važnih spojeva
| Amino kiselina | Spoj | Biološka uloga |
| Triptofan | serotonin | vazokonstriktor |
| NAD+ i NADP+ | Koenzimi dehidrogenaza | |
| dopamin | neurotransmiter | |
| adrenalin i noradrenalin | hormoni i transmiteri | |
| Tirozin | melanin | pigment kože, kose i očiju |
| tiroksin | hormon | |
| Histidin | histamin | lokalni upalni agens, regulira
želučanu sekreciju |
| Serin | holin | sastojak acetilholina i fosfolipida |
| porfirini | koenzimi koji vežu željezo | |
| Glicin | kreatin | fosfokreatin je skladišni oblik energije |
| glutation | unutarstanični reducens | |
| žučne soli | probava lipida | |
| purini | nukleotidni koenzimi, RNA, DNA | |
| Glutamat | GABA | neurotransmiter |
Iz aminokiselina organizam stvara proteinogene i neproteinogene aminokiseline. Tako se na primjer, aminokiseline koje tvore nove proteine u organizmu zovu proteinogene. Iz nekih aminokiselina mogu da se sintetiziraju masti i one su ketogene, dok aminokiseline koje stvaraju glukozu nazivamo glukogene. Tokom Krebsova ciklusa uree od aminokiselina biva uklonjena amino skupina te preko intermedijernih produkata može nastati glukoza. Taj metabolički proces je poznat kao glukoneogeneza. Iz aminokiselina stvara se ne samo glukoza, nego i prekursori sinteze masti i sama mast. Mnoge aminokiseline su istodobno i ketogene i glukogene. Glukogene mogu biti gotovo sve aminokiseline, ali su to najčešće alanin, glutamat i asparagin, te rjeđe cistein, glicin i serin. Ketogene aminokiseline za čovjeka su leucin i lizin dok treonin, izoleucin, fenil alanin, i tirozin mogu biti i glukogene i ketogene. U proces dezaminacije najviše su uključene glutaminska i asparginska kiselina.
Osim 20 proteinogenih aminokiselina u ljudskom tijelu se nalazi još oko stotinu neproteinogenih aminokiselina. One obavljaju najrazličitije funkcije. Iz njih organizam stvara, glukozu ili masti u stanicama gotovo cijelog tijela, a osobito u jetri, crijevima i mišićima.
Osim proteina, glukoze i masti, iz aminokiselina se sintetiziraju biogeni amini i drugi važni sintetski spojevi. Tako se iz glicina sintetizira hemoglobin, kreatin i glutation (tripeptid koji štiti organizam kao antioksidans, te u reduciranom obliku učestvuje pri prijenosu aminokiselina kroz membranu stanica). Iz tirozina stvaraju se kateholamini (adrenalin, noradrenalin) i hormoni štitnjače. Iz triptofana stvara se biogeni amin serotonin i nikotinska kiselina (niacin). Iz lizina se stvara karnitin, iz histidina biogeni amin histamin, iz cisteina taurin i glutation, a iz lizina i taurina zučne kiseline itd. Sve to govori o ogromnim mogućnostima prirode da iz najjednostavnijih elemenata stvara složene molekule- bjelančevine, masti, ugljične hidrate, vitamine, vodu, hormone, zaštitna protutijela, biogene amine itd.
Aminokiseline u hrani. Postoje aminokiseline koje ne ulaze u sastav proteina i nazivaju se neproteinske aminokiseline (npr. ß-alanin, ornitin, norleucin, norvalin i citrulin). Najviše aminokiselina koje su uglavnom u sastavu proteina ima u životinjskoj hrani pa se esencijalne aminokiseline uglavnom namiruju iz namirnica životinjskog porijekla, npr.: meso, riba, jaja, žitarice, jezgrasto voće i mahunasto povrće.
Većina aminokiselina danas se proizvode kao hidrolizati proteina i koriste kao dodaci prehrani u formi posebnih pripravaka. Koristi ih medicina u parenteralnoj prehrani u kliničkim uvjetima.
U ishrani stanovništva danas nedostaju uglavnom tri aminokiseline, to su triptofan, lizin i metionin. One predstavljaju limitirajući faktor iskorištenja hrane, zbog čega je potrebno da se izvori proteina raspodjele što pravilnije u ishrani ljudi i životinja. Nedostatak ovih proteina se može rješiti njihovim dodatkom u prehrambene proizvode biljnog porijekla, posebno žitarice u kojima je nedostatak ovih aminokiselina najveći. Namirnice biljnog porijekla sadrže u nedovoljnim količinama aminokiseline lizin, metionin i triptofan. Za osobe koji se hrane samo namirnicama biljnog porijekla je potrebno reći da su neki proteini biljnog porijekla komplementarni. Kombinovanjem različitih namirnica koje sadrže biljne proteine mogu se obezbijediti minimalne količine esencijalnih kiselina.
Tabela 3.2.6. Aminokiseline u hrani
| Izvor proteina | Manje prisutne aminokiselina |
| Pšenica | Lizin |
| Riža | Lizin |
| Leguminoze | Triptofan |
| Kukuruz | Lizin i triptofan |
| Grahorice | Metionin ( ili cistein) |
| Govedina | Fenilalanin ( ili tirozin) |
| Mlijeko ili sirutka | Metionin ili cistein |
Pravilnom prehranom unos esencijalnih aminokiselina je dovoljan i nema potrebe za suplementacijom.
Tabela 3.2.7. Aminokiseline neophodne za gradnju proteina u ljudskom organizmu
| Esencijalne (nezamjenjive) aminokiseline | ||
| Izoleucin | Lizin | Treonin |
| Leucin | Metionin | Triptofan |
| Fenilalanin | Valin | |
| Semiesencijalne aminokiseline | ||
| Arginin | ||
| Histidin | ||
| Neesencijalne (zamjenjive )aminokiseline | ||
| Alanin | Cistein | Prolin |
| Asparagin | Glutaminska kiselina | Serin |
| Asparaginska kiselina | Glutamin | Tirozin |
| Glicin | ||
Odnos aminokiselina i njihova zastupljenost u hrani, proces probave uz enzimsku hidrolizu proteina te ponovna sinteza proteina iz aminokiselina je složen proces u organizmu. Treba imati u vidu vrlo raznoliku ulogu aminokiselina i njihove različite anaboličke i kataboličke puteve. Kao što smo vidjeli, aminokiseline imaju različit hemijski sastav. Svaka od njih ima tačno određenu funkciju u organizmu. Neke se unose isključivo hranom (esencijalne), dok se druge mogu sintetizirati u organizmu.
Neke aminokiseline, kao slobodne, nalaze se u vrlo malim količinama u cirkulaciji i otopljene u drugim tjelesnim tekućinama. One su važne za prehrambenu i metaboličku kontrolu proteina u ljudskom tijelu. Tako slobodnog fenilalanina u našem tijelu ima samo 0.2% od njegove sveukupne količine. Mnogo više ima slobodnog glutamina i alanina. Na primjer u mišićima ima oko 10 – 15 g azota iz glutamina. Koncentracija slobodnih aminokiseline je veća u intracelularnoj tekućini nego u krvnoj plazmi. Aminokiseline leucin i fenilalanin su gotovo 2 puta više zastupljene u mišićnom tkivu nego u plazmi. Glutamin, glutaminske kiselina i glicin su čak 10 do 50 puta više zastupljeni u tkivnoj tekućini, nego u krvnoj plazmi. Koncentracija aminokiselina u krvnoj tekućini i u tkivima je bitna za normalno održanje organizma i razumjevanje mehanizma koji upravljaju sadržajem proteina u tkivima.
Tabele 3.2.8. RDI različitih aminokiselina za odrasle mg /kg TT
| Amino kiselina | RDI za odrasle mg /kg TT | mg/70 kg |
| Fenilalanin i tirozin | 14 | 980 |
| Leucin | 14 | 980 |
| Metionin i cistein | 13 | 910 |
| Lizin | 12 | 840 |
| Izoleucin | 10 | 700 |
| Valin | 10 | 700 |
| Treonin | 7 | 490 |
| Triptofan | 3 | 245 |
.
Ključni pojmovi
- Da bi organizam sintetisao proteine moraju biti prisutne sve esecijalne aminokiseline i to u odgovarajućim proporcijama.
- Odsustvo samo jedne od esencijalnih aminokiselina može štetno da utiče na sintezu proteina u organizmu i da proporcionalno umanji djelotvornost svih ostalih.
- Esencijalne aminokiseline su: triptofan, treonin, lizin, leucin, izoleucin, fenil alanin, metionin, valin te arginin i histidin.
- Neke od njih imaju izuzetan značaj za rast organizma.
- Aminokiseline: glicin, alanin, serin, glutaminska kiselina, glutamin, asparaginska kiselina, asparagin, prolin, cistein, tirozin, ljudski organizam može sam da sintetiše od produkata razlaganja bjelančevina ili od ostalih aminokiselina.
- Arginin, ornitin, cistein, cistin, glutamin, taurin i tirozin dio su neesencijalnih aminokiselina, ali kod nekih osoba zbog bolesti ili probavnih disfunkcija, također mogu biti esencijalne.
- Za novorođenče su esencijalne: cistein, taurin i arginin.
.
Literatura
Spisak korišćene literature možete naći u Literatura – Hemija hrane.